Железная руда: типы, способы добычи, сфера применения. Железная руда Физические свойства железной руды
Ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после ).
Смотрите так же:
СТРУКТУРА

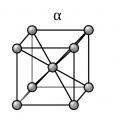
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а 0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a 0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С -а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С - аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) - д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа - это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая - 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа - хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо - один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

В земной коре железо распространено достаточно широко - на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало - в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe 2 O 4 , Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH 2 O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe 3 (PO 4) 2 ·8H 2 O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10 −5 -1·10 −8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe 2 O 3) и магнетита (FeO·Fe 2 O 3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства - восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe 1-x S) и когенит (Fe 3 C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO) n . В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Железо - один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов - важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов - например, никелевых.
Магнитная окись железа (магнетит) - важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
Цели
. Познакомить с положением железа
в периодической системе химических элементов
Д.И.Менделеева, строением атома, природными
месторождениями, соединениями, современными
методами получения, свойствами и применением
железа. Способствовать выработке у школьников
навыков коллективного труда и товарищеской
взаимопомощи.
Оборудование и реактивы
. Пробирки,
таблицы по доменному производству; растворы HCl и H 2 SO 4 ,
порошки Fe(OH) 2 и Fe(OH) 3 , железные опилки,
растворы желтой кровяной соли K 4
и красной кровяной соли K 3 .
Тип урока
. Элементы лекции, рассказ,
беседа.
ХОД УРОКА
Учитель
. Сегодня мы продолжим речь о
металлах, вы узнаете о положении железа в
периодической системе химических элементов, о
строении его атома, о химических свойствах
металла железа, его соединениях, получении и
применении, роли железа в развитии человеческого
общества. Какова роль железа в человеческом
обществе?
Ученик
. Железо сыграло большую роль в
развитии человеческого общества и не потеряло
своего значения в настоящее время. Из всех
металлов оно наиболее широко используется в
современной промышленности.
Первобытный человек начал использовать железные
орудия труда за несколько тысячелетий до нашей
эры. В те годы единственным источником этого
металла были упавшие на землю метеориты, которые
содержат довольно чистое железо. В середине 2-го
тысячелетия до
н. э. в Египте была освоена металлургия железа –
получение его из железных руд. Это событие стало
началом железного века в истории человечества,
который пришел на смену каменному и бронзовому
векам. На территории России начало железного
века относится к рубежу 2–1-го тысячелетий до н. э.
Учитель
. Каково распространение
железа в природе?
Ученик
. Железо – один из самых
распространенных элементов в природе. В земной
коре его массовая доля составляет 5,1%, по этому
показателю оно уступает только кислороду,
кремнию и алюминию. Много железа находится и в
небесных телах, что установлено по данным
спектрального анализа. В образцах лунного
грунта, которые доставила советская
автоматическая станция «Луна», обнаружено
железо в неокисленном состоянии
.
Учитель
. В виде каких соединений
железо встречается в природе?
Ученик
. Железо входит в состав
большинства горных пород. Для получения железа
используют железные руды с содержанием железа
30–70% и более.
(Пользуясь физической картой
России, ученик показывает и называет
месторождения соединений железа.)
Основными железными рудами являются:
– гематит
Fe 2 O 3
– содержит до 65% железа, такие месторождения
железа встречаются в Криворожском районе;
– лимонит
Fe 2 O 3 n
H 2 O
– содержит до 60% железа, месторождения лимонита
встречаются в Крыму, например керченское
месторождение;
– пирит
FeS 2 – содержит
примерно 47% железа, месторождения пирита
встречаются на Урале.
Учитель
. Как получают железо в
промышленности?
Ученик
. В настоящее время основным
промышленным способом переработки железных руд
является производство чугуна доменным
процессом. Чугун
– это сплав железа,
содержащий
2,2–4% углерода, а также кремний, марганец, фосфор,
серу. В дальнейшем большая часть чугуна
подвергается переделу в сталь. Сталь
отличается от чугуна главным образом меньшим
содержанием углерода (до 2%), фосфора и серы.
Учитель
. Большое внимание уделяется
разработке методов прямого получения железа из
руд без осуществления доменного процесса. В чем
преимущество прямого получения железа? Главное
состоит в том, что восстановление оксидов железа
можно проводить без участия металлургического
кокса. Его заменяют более дешевым и
распространенным топливом – бурым углем,
природным газом. При прямом получении железа
можно использовать и бедные железные руды, шлаки
других производств, содержащие железо.
Прямое восстановление железа проводят в слегка
наклоненных вращающихся печах, похожих на печи, в
которых получают цемент. В печь непрерывно
загружают руду и уголь, которые постепенно
перемещаются к выходу, противотоком идет
нагретый воздух, создается температура ниже
точки плавления железа.
Чтобы получить технически чистое железо прямым
восстановлением, руду подвергают обогащению. При
этом удается повысить массовую долю железа,
отделить пустую породу (куски железа легко
отделяются от шлака) и снизить содержание
вредных примесей (серы и фосфора). В процессе
обогащения руду измельчают в дробильных
установках и подают в магнитный сепаратор.
Последний представляет собой барабан с
электромагнитами, в который при помощи
транспортера подается измельченная руда. Пустая
порода свободно проходит через магнитное поле и
падает. Зерна руды, содержащие магнитные
минералы железа, намагничиваются и отделяются от
барабана позднее пустой породы. Такую магнитную сепарацию
можно проводить несколько раз.
Затем руду обогащают методом флотации
. Для
этого руду помещают в емкость с водой, где
растворяют флотационные поверхностно-активные
вещества, которые избирательно абсорбируются на
поверхности полезного минерала. В результате
абсорбции флотореагента частицы минерала не
смачиваются водой и в ней не тонут. Через раствор
пропускают воздух, пузырьки которого
прикрепляются к кусочкам минерала и поднимают их
на поверхность. Частицы пустой породы хорошо
смачиваются водой и оседают на дне емкости.
Обогащенную руду собирают с поверхности
раствора вместе с пеной. В результате содержание
железа в руде может быть повышено до 70–72%
.
Рассмотрим схему одного из способов прямого
получения железа. Процесс проводят в
вертикальной печи, в которую сверху подают
обогащенную руду, а снизу – газ, служащий
восстановителем. Этот газ получают сжиганием
природного в недостатке кислорода.
Восстановительный газ содержит 30%
СО, 55%
Н 2 ,
13%
Н 2 О и 2%
СО 2 . Следовательно,
восстановителями служат оксид углерода(II)
СО
и водород:
Fe 2 O 3 + 3СО = 2Fe + 3CO 2 ,
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
Восстановление ведут при температуре
850–900 °С, что ниже температуры плавления
железа (1539 °С).
Для многих современных отраслей техники
требуется железо очень высокой степени чистоты.
Тогда очистку технического железа проводят карбонильным
методом. Карбонилы – это соединения металлов с
оксидом углерода(II) СО. Железо взаимодействует с
СО при повышенном давлении и температуре
100–200 °С, образуя пентакарбонил железа:

Пентакарбонил железа – жидкость, которую легко можно отделить от примесей перегонкой. При температуре около 250 °С карбонил легко разлагается, образуя порошок железа:
Fe(CO) 5 = Fe + 5CO.
Если полученный порошок подвергнуть спеканию
в вакууме, то получится металл, содержащий
99,98–99,999% железа. Зачем нужно получать металл
такой степени чистоты?
Ученик
. Железо высокой степени
чистоты нужно прежде всего для изучения его
свойств, т.е. для научных целей. Если бы не удалось
получить чистое железо, то не узнали бы, что это –
мягкий, легко обрабатывающийся металл. Химически
чистое железо намного более инертно, чем железо
техническое. Важной отраслью использования
чистого железа является производство
специальных ферросплавов, свойства которых
ухудшаются от присутствия примесей
.
Учитель
. Каковы же химические
свойства железа?
Ученик
. Химические свойства железа
обусловлены строением электронных оболочек его
атомов. Железо – элемент побочной подгруппы VIII
группы 4-го большого периода. Железо относится к
d-элементам, электронная формула атома имеет
окончание …3d 6 4s 2 . Железо в соединениях
проявляет степени окисления +2 и +3. Максимальная
степень окисления железа +6. Она проявляется в
ферратах – солях несуществующей железной
кислоты. Например,
Na 2 FeО 4 – феррат
натрия
.
Учитель
. Как реагирует железо с
кислородом?
Ученик
. В электрохимическом ряду
напряжений железо стоит левее водорода, т. е.
имеет более отрицательный стандартный
электродный потенциал. Поэтому железо легко
растворяется в соляной и разбавленной серной
кислотах с выделением водорода
:
Fe + 2HCl = FeCl 2 + H 2 ,
Fe + H 2 SO 4 (разб.) = FeSO 4 + H 2 .
Более концентрированную серную кислоту (40–60%)
железо восстанавливает до
оксида серы(IV):
Fe + 2H 2 SO 4 = FeSO 4 + SO 2 + 2H 2 O.
В серной кислоте еще более высокой
концентрации (от 80 до 100%) железопассивируется
– покрывается тонкой и прочной оксидной пленкой,
которая предохраняет металл от растворения.
Такое же явление пассивации наблюдается и в
сильно концентрированной азотной кислоте,
поэтому концентрированные серную и азотную
кислоты можно перевозить в железной таре.
С разбавленной азотной кислотой железо может
реагировать с образованием соли железа(II), а с
более концентрированным раствором кислоты –
соли железа(III) и различных продуктов
восстановления кислоты, например:
4Fe + 10HNO 3 = 4Fe(NO 3) 2 + NH 4 NO 3 + 3H 2 O,
3Fe + 8HNO 3 = 3Fe(NO 3) 2 +2NO + 4H 2 O,
Fe + 6HNO 3 = Fe(NO 3) 3 + 3NO 2 + 3H 2 O.
Учитель
. Вспомните, что называется
коррозией. Каковы ее последствия?
Ученик
. Коррозия – это разрушение
металла под действием окружающей среды.
Образование ржавчины можно представить в
следующем виде:
4Fe + 3О 2 + 6H 2 O = 4Fe(OН) 3 ,

Ржавчина отслаивается от поверхности
металла, имеет много пор, поэтому не предохраняет
металл от дальнейшей коррозии. Из-за коррозии
гибнет огромное количество железа и его сплавов.
В XIX в., когда не существовало надежных методов
борьбы с коррозией, от нее гибла половина
выплавляемого металла. В современных условиях от
коррозии гибнет 1/6 часть выплавляемого чугуна.
Поэтому борьба с коррозией – одна из важнейших
задач человечества
.
Учитель
. Обладают ли амфотерностью
соединения железа?
(На поставленный вопрос может ответить сам
учитель или заранее подготовленный,
интересующийся химией ученик.)
Гидроксид железа(III) амфотерен, т. е. проявляет
свойства основания в реакции с кислотами:
Fe(OH) 3 + 3HCl = FeCl 3 + 3H 2 O,
и кислотные свойства в реакциях с концентрированными растворами щелочей:
Амфотерный характер имеет и оксид железа(III), который реагирует и с кислотами, и с основными оксидами:
Fe 2 O 3 + 6HСl = 2FeCl 3 + 3H 2 O,
![]()
Учитель заостряет внимание учащихся на том, что
существуют характерные реакции на соединения
двухвалентного и трехвалентного железа,
сопровождая свой рассказ проведением опытов.
Учитель
. Для обнаружения ионов
железа(III) удобно применять комплексное
соединение железа, называемое желтой кровяной
солью или гексацианоферратом(II) калия
K 4 .
При взаимодействии ионов
(Fe(CN) 6) 4–
с ионами
Fe 3+ образуется темно-синий
осадок – берлинская лазурь:

Другое соединение железа – красная кровяная
соль или гексацианоферрат(III) калия K 3
является реактивом на ионы
Fe 2+ .
При взаимодействии ионов
(Fe(CN) 6) 3– с
ионами
Fe 2+ также образуется темно-синий
осадок – турнбулева синь:

Перечислите основные области применения
железа. Какое природное значение имеет железо?
(Учащиеся отвечают на поставленные вопросы,
учитель поясняет их ответы.)
Первый ученик
. Ферраты различных
металлов используют в современных отраслях
радиоэлектроники и автоматики
.
Второй ученик
. Необычные соединения
образует железо с водородом, азотом и углеродом.
Атомы этих неметаллов имеют размеры меньше
атомов железа и легко внедряются между узлов
кристаллической решетки металла, образуя
твердые растворы внедрения.

Твердые растворы внедрения внешне похожи на
металл, но их свойства сильно отличаются от
свойств железа. Большей частью это очень твердые
и хрупкие вещества. С водородом железо
образует гидриды
FeH и
FeH 2 , с азотом –
нитриды
Fe 4 N и
Fe 2 N, с углеродом –
карбид
Fe 3 С – цементит, содержащийся в
чугуне и стали
.
Третий ученик
. Железо – это металл,
использование которого в промышленности и быту
не имеет пределов. Широко распространена сталь в
современной технике. Оксиды и соли железа
применяют в производстве красок, магнитных
материалов, катализаторов, лекарственных
препаратов, удобрений
.
Четвертый ученик
. Без железа не может
функционировать организм человека, в нем
содержится около 3–4 г железа, из них в крови – 2 г.
Железо входит в состав гемоглобина.
Недостаточное содержание железа в организме
человека приводит к головной боли, быстрой
утомляемости и другим заболеваниям. Железо также
необходимо для роста растений. В целом по
значимости железо в настоящее время является
главным металлом
.
Для закрепления изученного материала учащимся предлагаются следующие вопросы .
1. Каково положение железа в периодической системе химических элементов?
2. Какие степени окисления проявляет железо в соединениях?
3. Какие соединения железа обладают амфотерными свойствами?
4. Как реагирует железо с азотной и серной кислотами различной концентрации?
5. Как отличить соединения двух- и трехвалентного железа?
6. Каково применение и значение соединений железа на современном этапе развития человечества?Если позволяет время, то можно закрепить рассмотренный материал по производству железа, используя следующие вопросы .
1. В чем преимущество прямого метода получения железа?
2. Для чего применяют обогащение руды?
3. Как обогащают руду методом флотации?
4. В чем основной смысл очистки технического железа карбонильным методом?
ЛИТЕРАТУРА
Книга для чтения по неорганической химии. Сост.
В.А.Крицман, М.: Просвещение, 1984;
Фельдман Ф.Г., Рудзитис Г.Е.
Химия. Учебник для
9 класса общеобразовательных учебных учреждений.
М.: Просвещение, 1999;
Хомченко Г.П.
Химия для поступающих в вузы. М.:
Высшая школа, 1993.
|
Магнетит | ||
|
Магномагнетит |
(Мg ,Fe) О·Fe 2 О 3 | |
|
Титаномагнетит* | ||
|
Гидрогётит (лимонит) | ||
|
* Магнетит с изоморфной примесью титана или гомогенный твердый раствор магнетита и ульвошпинели. К титаномагнетиту часто относят и ильменомагнетит – магнетит с ильменитовыми продуктами распада твердого раствора. |
||
6. По количеству общих (на 01.01.2003 г. – 100 млрд. т – 16,1 % мировых) и разведанных (56,1 млрд. т – 18,6 % мировых) запасов железных руд Россия устойчиво занимает первое место в мире, полностью удовлетворяет свои потребности в железорудном сырье и значительные объемы товарных железных руд, концентратов, окатышей, горячебрикетированного железа ежегодно поставляет на экспорт.
7. Железорудные месторождения промышленного значения весьма разнообразны. Они известны в эндогенных, экзогенных и метаморфогенных комплексах пород. С учетом генезиса принято выделять следующие основные промышленные типы.
8. Магматические месторождения:
а) титаномагнетитовые и ильменит-титаномагнетитовые, представляющие собой зоны концентрированной вкрапленности (с шлировыми и жило-линзообразными обособлениями) ванадий- и титансодержащих магнетитов в интрузивах габбро-пироксенит-дунитовой, габбровой, габбро-диабазовой и габбро-анортозитовой формаций (Качканарское, Копанское, Первоуральское на Урале, Пудожгорское в Карелии, Чинейское в Читинской области, месторождения Бушвельдского комплекса в ЮАР, Роутивара, Таберг в Швеции, Аллард-Лейк (Лак-Тио) в Канаде и др.);
б) бадделеит-апатит-магнетитовые, образующие серии линзо- и жилообразных тел в ультраосновных щелочных интрузивах с карбонатитами (Ковдорское на Кольском полуострове, Палабора в Южной Африке).
На долю титаномагнетитовых и бадделеит-апатит-магнетитовых руд приходится 6,6 % мировых разведанных запасов и 5,6 % производства товарных руд. В России они составляют 12,9 % в запасах и 18,2 % в производстве товарных руд.
9. Метасоматические месторождения (месторождения скарново-магнетитовых руд) представлены в разной степени оруденелыми скарнами и скарноидами, образующими сложные пласто- и линзообразные залежи магнетитовых руд в осадочных, вулканогенно-осадочных и метаморфических породах (Соколовское, Сарбайское, Качарское в Казахстане; Высокогорское, Гороблагодатское и другие на Урале; Абаканское, Тейское в Красноярском крае; Шерегешевское, Таштагольское и другие в Горной Шории; Таежное, Десовское в Якутии; Маркона в Перу, месторождения Чилийского железорудного пояса; Чогарт, Чадор-Малю в Иране; Мааншань в Китае). На долю скарново-магнетитовых руд приходится 9,5 % мировых разведанных запасов и 8,3 % производства товарных руд. Руды данного типа в России составляют соответственно 12,2 и 12,9 %.
10. Гидротермальные месторождения:
а) генетически связанные с траппами и представленные жило-столбообразными и различной сложной формы залежами магномагнетитовых руд в осадочных, пирокластических породах и траппах (Коршуновское, Рудногорское, Нерюндинское, Капаевское, Тагарское в Восточной Сибири);
б) гидротермально-осадочные сидеритовые, гематит-сидеритовые, представленные пласто-, жило- и линзообразными согласными и секущими залежами сидеритовых, гематит-сидеритовых (в верхних горизонтах окисленных) руд в осадочных породах (Бакальское рудное поле на Урале, Березовское в Читинской области, Уэнза, Бу-Кадра, Заккар-Бени-Саф в Алжире, Бильбао в Испании).
Доля руд данного типа в разведанных запасах и производстве товарных руд в мире незначительна и не превышает 1 %, в России в запасах она составляет – 5,4 %, в производстве товарных руд – 2,9 %.
11. Вулканогенно-осадочные месторождения – согласные пласты и линзы гематитовых, магнетит-гематитовых и гематит-магнетитовых руд в вулканогенно-осадочных породах (Западно-Каражальское в Казахстане, Холзунское на Алтае). Доля руд данного типа в разведанных запасах и производстве товарных руд в мире незначительна. В России такие месторождения пока не разрабатываются.
12. Осадочные морские месторождения, образовавшиеся в морских бассейнах и представленные слабо дислоцированными пластовыми залежами лептохлоритовых и гидрогётитовых оолитовых руд в морских терригенно-карбонатных мезокайнозойских отложениях (Керченский железорудный бассейн на Украине, Аятское в Казахстане, месторождения бурых железняков Лотарингского железорудного бассейна (на территории Франции, Бельгии, Люксембурга), Великобритании, Германии, провинции Ньюфаундленд Канады и Бирмингемского района в США). Доля руд данного типа в разведанных запасах в мире составляет 10,6 %, в производстве товарных руд – 8,9 %. В России такие месторождения не разведаны и не отрабатываются.
13. Осадочные континентальные месторождения, образовавшиеся в речных или озерных бассейнах и представленные пластовыми и линзообразными залежами лептохлоритовых и гидрогётитовых оолитовых руд в ископаемых речных отложениях (Лисаковское в Казахстане). Доля руд данного типа в разведанных запасах и производстве товарных руд в мире незначительна. В России такие месторождения не разведаны и не отрабатываются.
14. Метаморфизованные железистые кварциты широко распространены на древних щитах, платформах и на некоторых срединных массивах фанерозойских складчатых областей. Большинство их имеет раннепротерозойский и архейский возраст; значительно меньше распространены позднепротерозойские и раннепалеозойские месторождения. Железистые кварциты образуют огромных размеров железорудные бассейны. Рудные залежи кварцитов в пределах месторождений обычно имеют крупные размеры: километры по простиранию, первые сотни или десятки метров по мощности. Характерна пластообразная форма рудных тел, тонкополосчатые текстуры и сходный минеральный состав руд на различных месторождениях (Криворожский бассейн на Украине, в России – месторождения Курской магнитной аномалии, Оленегорское на Кольском полуострове, Костомукшское в Карелии, Тарыннахское и Горкитское в Якутии, в Австралии – бассейн Хамерсли, в Бразилии – район Каражас и «Железного четырехугольника», в США – район оз. Верхнего, в Канаде – Лабрадорский прогиб, в Китае – бассейн Аньшань-Бенси и др.). Крупные и уникальные по запасам месторождения, легкая обогатимость руд, возможность разработки открытым способом большими карьерами с применением мощной горнодобывающей и транспортной техники позволяют считать их благоприятными объектами добычи железных руд во всех бассейнах мира. Доля руд данного типа в разведанных запасах и производстве товарных руд в мире превышает 60 %, в России в запасах она составляет – 55,9 %, в производстве товарных руд – 64,5 %.
15. Месторождения кор выветривания, представленныебогатыми гидрогематит- и сидерит-магнетитовыми, мартит-магнетитовыми рудами, формируются при преобразовании железистых кварцитов в результате гипергенных процессов. В соответствии с этим в своем распространении они связаны с районами и площадями развития железистых кварцитов, приурочены к развивающимся по ним площадным и линейным корам выветривания (Михайловское, Яковлевское, Гостищевское, Висловское, Разуменское в России, месторождения богатых руд Кривого Рога на Украине, железорудные районы Австралии, Бразилии, Индии, США). На долю месторождений данного типа приходится 12,5 % разведанных запасов России и 1,3 % производства товарных руд. В сумме доля месторождений двух последних типов – железистых кварцитов и развивающихся по ним полигенных богатых железных руд – составляет в мире 70,9 % разведанных запасов и 74,4 % производства товарных руд, т.е. это наиболее важные промышленные типы месторождений. Доля руд двух последних типов месторождений в России составляет в запасах 68,4 %, в производстве товарных руд – 65,8 %.
16. Прочие гипергенные железные руды:
а) бурые железняки, связанные с корами выветривания сидеритов (Бакальская и Зигазино-Комаровская группы месторождений на Урале, Березовское в Читинской области);
б) прерывистые плащеобразные залежи хром-никелевых гётит-гидрогётитовых руд, распространенные в коре выветривания ультраосновных пород (латеритные руды Кубы, Филиппин, Индонезии, Гвинеи, Мали, на Урале – Серовское и месторождения Орско-Халиловского района). Такие руды, как правило, легированы никелем и кобальтом.
Доля прочих гипергенных железных руд в разведанных запасах в мире составляет 2,4 %, в производстве товарных руд – 2,0 %, в России соответственно 1,1 и 0,2 %.
17. В зависимости от условий образования чрезвычайно разнообразен и минеральный состав железных руд, определяющий в значительной степени их промышленную ценность. Железные руды подразделяются на 11 основных промышленных типов (табл. 2).
Цели урока:
Образовательная:
- На основании знаний учащихся о строении атомов металлов, об особенностях химической связи, свойствах металлов - простых веществ и их соединений, изучить особенности строения атома железа и проследить взаимосвязь строения атома железа, его свойств и свойств его соединений; познакомиться с важнейшими соединениями железа.
- Развить познавательный интерес к предмету, реализоватьмежпредметныесвязи курсов химии, биологии, истории, географии и литературы.
Развивающая:
- Развить умение учащихся анализировать, сравнивать, обобщать и делать выводы на основании уже имеющихся и вновь полученных знаний, как по химии, так и по другим дисциплинам.
- Прививать навыки поисковой и самостоятельной работы.
- Продолжить работу над формированием навыков по применению знаний при решении теоретических и практических задач (формирование предметной компетентности).
Воспитательная: Содействовать в ходе урока формированию научного мировоззрения, коммуникативной и информационной компетенции.
Тип урока: Урок усвоения новых знаний. Первичное закрепление новых знаний.
Форма организации учебной деятельности обучающихся: групповая, преобладающая работа - самостоятельная. Урок с элементамитехнологии критического мышления.
Оборудование: ПСХЭ, кристаллические решетки металлов, видеоролики, подтверждающие химические свойства железа и его соединений, реактивы (железо в порошке, сера, растворы соляной и серной кислот, сульфат меди, гидроксид натрия, красная и желтая кровяные соли, сульфат железа (II), хлорид железа (III),тиоционат калия),мультимедийное оборудование, диск с записью презентации, электронное пособие по теме "Металлы".
ХОД УРОКА
I. Организационный момент (1-2 мин)
1 стадия "Вызов".На этой фазе происходит актуализация знаний, имеющихся у учащихся, возникает интерес к обсуждаемому вопросу.
Краткое вступительное слово учителя (3 мин.).
Сегодня мы с вами продолжим путешествие в мир металлов: мы не только будем исследовать настоящее, но и заглянем далекое прошлое. Внимание посетителей Всемирной промышленной выставки в 1958 г в Брюсселе привлекло здание Атомиума.Девять громадных, диаметром 18 метров, металлических шаров, как бы парили в воздухе: восемь по вершинам куба, девятый в центре. Это была модель элементарной ячейки кристаллического альфа-железа, увеличенная в 165 млрд. раз (слайд 2)
Учитель объявляет тему урока:"Железо и его соединения" (слайд 3)
Прием "Покопаемся в памяти"
2 стадия - Осмысление новой информации. Учитель предлагает учащимся новую информацию, которую они должны усвоить. На этом этапе может быть предложена работа с текстом, заполнение матричной таблицы, чтение текста с пометками, выписка из текста.
Нахождение железа в природе.
Учащимся раздается печатный материал (Важнейшие природные соединения железа), демонстрируются минералы содержащие железо.
Работа с таблицей.
Ответить на вопросы: а) Какие классы неорганических соединений входят в состав железных минералов? б) Какой минерал имеет самое высокое значение массовой доли железа? в) В каких регионах России добывают железо?
Важнейшие природные соединения железа (слайд 4)
| Название минерала | Химическая формула | Содержание железа (в %) |
Важнейшие месторождения |
| Магнитный железняк (магнетит) |
Fe 3 O 4 | до 72 | Ю. Урал, Магнитогорск, КМА, Кольский п-ов |
| Красный железняк (гематит) |
Fe 2 O 3 | до 65 | Кривой рог, Сев. Урал, КМА |
| Бурый железняк (лимонит) |
2Fe 2 O 3 *3H 2 O | до 60 | Керчь, Ю. Урал, Карелия, Липецкая и Тульская обл. |
| Шпатовый железняк (сидерит) |
FeCO 3 | до 35 | Ю. Урал, КМА, Керчь |
| Серный колчедан (пирит) |
FeS 2 | до 47 | Урал, Алтай, Закавказье |
2. Физические свойства железа. Кристаллические решетки железа (слайд 5,6,7)
Прием "Кластер"
1. Напишите в середине листа ключевое выражение: "Физические свойства железа"
2. Начните записывать слова или предложения, которые приходят на ум в связи с данным заданием.
З. По мере того, как у вас возникают идеи, и вы записываете их, начните устанавливать те связи между идеями, которые вам кажутся подходящими.
4. Выпишите столько идей, сколько придёт вам на ум, пока не будут исчерпаны все ваши идеи.
На этом этапе урока возможно использование приема " Маркировочная таблица"(работая с текстом, учащиеся заполняют таблицу)например:
| "+" (знаю) |
"-" (Противоречит моему знанию) |
"V"
(Это для меня новое) |
"?" (Не понятно) |
| Простое вещество с металлической связью. Обладает пластичностью и ковкостью. | Железо символ планеты МАРС | Имеет 4 аллотропные модификации | |
| Железо проводит тепло и электрический ток. | Самый распространенный металл на Земле | ||
| Железо имеетметаллический блеск, обладает магнитными свойствами | Самый блестящий металл железо. | Свет поглощается поверхностью металла, и его электроны начинают испускать свои, вторичные, волны излучения. | Почему проводит тепло. |
3. Положение атома железа в периодической системе и строение атома (слайд 8)
26 Fe)))) d - элемент VIII-В группы, Аr = 56 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
4. Химические свойства железа (Слайд 9,10)
На этом этапе урока возможно использование приема "Самоанализ" с опорой на знания общих свойств металлов.
А) При нагревании взаимодействует со многими неметаллами:
* с кислородом 3Fe + 2O 2 = Fe 3 O 4
* c хлором 2Fe + 3Cl 2 = 2FeCl 3
* cсерой Fe + S = FeS
* c азотом 2Fe + N 2 = 2FeN
Б) Пары воды разлагаются раскаленным железом: 3Fe + 4H 2 O = Fe 3 O 4 + 4H 2
В)РазбавленныеHCL и H 2 SO 4 растворяют железо.
Fe + H 2 SO 4 = FeSO 4 + H 2 Fe + 2HCl = FeCl 2 + H 2
Г) С концентрированными азотной и серной кислотами при обычных условиях не реагирует (кислоты пассивируют металл)
Д) При нагревании реакция с концентрированной серной кислотой идет по уравнению 2Fe + 6H 2 SO 4 = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Е) Взаимодействуетссолями: Fe + CuCl 2 = FeCl 2 + Cu
5. Свойства соединений Fe +2 и Fe +3 (слайд 11, 12)
| СОЕДИНЕНИЯ ЖЕЛЕЗА | ||
| +2 | +3 | |
| ОКСИДЫ | ||
| FeO - основный | Fe 2 O 3 - слабо амфотерный | |
| Общие свойства: 1. Не растворяются в воде |
||
| 2. Реагируют с кислотами | ||
| FeO+2HCl = FeCl 2 + H 2 O FeO + 2H + = Fe 2+ + H 2 O |
Fe 2 O 3 + 6HCl = 2FeCl 3 +3H 2 O Fe 2 O 3 + 6H + = 2Fe 3+ + 3H 2 O |
|
| 3. Реагируют с кислотными оксидами | ||
| FeO + SO 3 -> FeSO 4 | Fe 2 O 3 + 3SO 3 -> Fe 2 (SO 4) 3 | |
| 4. Реагируют с восстановителями | ||
| Fe0 + H 2 = Fe + H 2 O | Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O | |
| Различия: | ||
| 1. Неустойчивые соединения | 1.Реагируют с щелочами: Fe 2 O 3 +2NaOH -> 2NaFeO 2 +H 2 O Fe 2 O 3 +2KOH+3H 2 O=2K |
|
| Гидроксиды железа | ||
| Fe(OH) 2 - основный | Fe(OH) 3 - слабо амфотерный | |
| Общие свойства: | ||
| 1.Реагируют с кислотами: Fe(OH) 2 +2HCl=FeCl 2 +2H 2 O Fe(OH) 2 + 2H + = Fe 2+ + 2H 2 O 2.При t 0 разлагаются: Fe(OH) 2 = FeO + H 2 O |
1.Реагируютскислотами: Fe(OH) 3 +3HCl=FeCl 3 +3H 2 O Fe(OH) 3 + 3H + = Fe 3+ + 3H 2 O 2.При t 0 разлагаются: 2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O |
|
| Различия: | ||
| 1.Окисляется на воздухе: 4Fe(OH) 2 +2H 2 O+O 2 =4Fe(OH) 3 |
1.Реагируют с щелочами: Fe(OH) 3 +KOH=K Fe(OH) 3 + OH - = - |
|
6. Лабораторные опыты. Качественные реакции на ионы Fe +2 , Fe +3 .
1. К раствору сульфата железа (II) - (FeSO 4) добавить несколько капель раствора гексацианоферрата (III) калия - красной кровяной соли K 3 . Наблюдаем выпадение осадка турнбулевой сини. Какого цвета?
Записать уравнение реакции:FeSO 4 +K 3 ->
2. К раствору хлорида железа (III) - (FeCl 3) добавить несколько капель раствора гексацианоферрата (II) калия K 4 - желтой кровяной соли. Отметить цвет осадка берлинской лазури. Записать уравнение реакции:
FeCl 3 + K 4 ->
3. К раствору хлорида железа (III) добавить несколько капель раствора тиоцианата калия (KCNS). Наблюдаем цвет раствора. Записать уравнение реакции:
FeCl 3 + KCNS ->
7. Практическое значение солей железа (слайд 13)
- FeSO 4 * 7H 2 O - железный купорос; применяется в текстильной промышленности при крашении тканей, в сельском хозяйстве для протравы семян и борьбы с вредителями сельского хозяйства, получение чернила.
- FeCl 2 - хлорид железа (II); применяется для получения чистого железа, компонент антианемических препаратов, катализатор в органическом синтезе.
- FeCl 3 - хлорид железа (III); применяется в технике как окислитель в производстве органических красителей, в текстильной промышленности - для протравки тканей при подготовке их к окраске, в медицине как кровоостанавливающее средство, компонент тонирующих растворов в фотографии, коагулянт при очистке воды, для определения фенолов.
- Fe 2 (SO 4) 3 - сульфат железа (III); применяется как химический реактив при гидрометаллургической переработке медных руд, как коагулянт при очистке сточных вод, для получения квасцов, пигмента Fe 2 O 3 .
3 стадия - Рефлексия, Размышление. Происходит осмысление всей информации, полученной на 2 стадии. Размышление и обобщение того, "что узнал"ребенок на уроке по данной проблеме. На этой стадии может быть составлен опорный конспект в тетради учащегося. Кроме того, могут быть осуществлены:
а) возврат к стадии вызова;
б) возврат к ключевым словам;
в) возврат к перевернутым логическим цепочкам;
г) возврат к кластерам.
Возможно использование приемов: "Перепутанные логические цепочки"
или "Синквейн":
- на первой строчке тема называется одним словом (существительным)
- вторая строчка - это описание темы в двух словах (прилагательных).
- третья строка-описание действия в рамках темы тремя глаголами.
- четвертая - это фраза из четырех слов, показывающая отношение к теме.
- пятая - синоним из одного слова, который повторят суть темы.
или "Конструирование текста" (слайд 14)
Задание: Из предложенных формул соединений составьте генетический ряд Fe +2 (для первого варианта) и генетический ряд Fe +2 (для второго варианта).
Fe(OH) 2 , Fe, Fe(OH) 2 , FeCl 3 , Fe 2 O 3 , FeCl 2 , FeO
8. Домашнее задание (слайд 14)
1. Написать уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
Fe -> FeCl 3 -> Fe(OH) 3 -> Fe 2 O 3 -> Fe -> FeSO 4 -> Fe(OH) 2 -> FeOa Fe -> Fe 3 O 4
2. Написать уравнения реакций ступенчатого гидролиза раствора Fe 2 (SO 4) 3 .
3. В уравнении химической реакции расставить коэффициенты методом электронного баланса: Fe 2 O 3 + KOH + KNO 3 -> K 2 FeO 4 + KNO 2 + H 2 O
Железо относится к группе самородных элементов. Самородное железо является минералом, имеющим земное и космогенное происхождение. Содержание никеля на 3 процента выше в земном железе, по сравнению с космогенным. Также содержатся примеси магния, кобальта и других микроэлементов. Самородное железо имеет светло-серый цвет с металлическим блеском, включения кристаллов редки. Это достаточно редкий минерал, обладающий твердость в 4-5 ед. и плотностью в 7000-7800 кг на метр кубический. Археологи доказали, что самородное железо использовалось древними людьми задолго до того, как появились навыки по выплавке металла железа из руды.
Данный металл в своем первоначальном виде имеет серебристо-белый оттенок, поверхность стремительно покрывается ржавчиной при высокой влажности или в воде, богатой кислородом. Данная порода отличается хорошей пластичностью, плавится при температуре в 1530 градусов по Цельсию, из него без труда можно ковать изделия и производить прокатку. Металл обладает хорошей электро- и теплопроводностью, дополнительно его отличают от других пород магнитные свойства.
При взаимодействии с кислородом поверхность металла покрывается образующейся пленкой, которая защищает его от коррозийного воздействия. А при содержании в воздухе влаги железо окисляется, и на его поверхности образуется ржавчина. В некоторых кислотах железо растворяется, и происходит выделение водорода.
История появления железа
Железо оказало огромное влияние на развитие человеческого общества и продолжает цениться сегодня. Его используют на многих производствах. Железо помогло первобытному человеку освоить новые способы охоты, привело к развитию сельского хозяйства благодаря новым орудиям. Железо в чистом виде в те времена было частью упавших метеоритов. По сегодняшний день ходят легенды о неземном происхождении данного материала. Металлургия берет свое начало в середине второго тысячелетия до н.э. В то время в Египте освоили получение металла из железной руды.
Где добывают железо?
В чистом виде железо содержится в небесных телах. Металл был обнаружен в лунном грунте. Сейчас железо добывают из руды горных пород, и Россия занимает лидирующее место по добыче этого металла. Богатые залежи железной руды расположены в европейской части, в Западной Сибири и на Урале.
Области применения
Железо необходимо при производстве стали, которая имеет широкий диапазон применения. Практически в каждом производстве используется данный материал. Широко применяется железо в быту, его можно встретить в виде кованных изделий и чугуна. Железо позволяет придавать изделию различную форму, поэтому его используют при ковке и создании беседок, ограждений и других изделий.
Пользуются железом все хозяйки на кухне, ведь изделия из чугуна, это не что иное как сплав железа и углерода. Посуда из чугуна равномерно нагревается, долго сохраняет температуру и служит не один десяток лет. В состав практически всех столовых приборов входит железо, а из нержавеющей стали изготовляют посуду и различные кухонные принадлежности и такие необходимые предметы, как лопаты, вилы, топоры и другие полезные приспособления. Широко используется данный металл и в ювелирном деле.
Химический состав
Теллурическое железо содержит примеси никеля (Ni) 0,6-2%, кобальта (Со) до 0,3%, меди (Сu) до 0,4%, платины (Pt) до 0,1%, углерода; в метеоритном железе никель составляет от 2 до 12%, кобальт-около 0,5%, имеются также примеси фосфора, серы, углерода.
Поведение в кислотах: растворяется в НNО3.
В природе существует несколько модификаций железа - низкотемпературная имеет ОЦК ячейку (Im3m), высокотемпературная (при температурах > 1179K) ГЦК ячейку (Fm(-3)m). В больших количествах содержится в метеоритах. В железных метеоритах при травлении или нагреве проявляются видманштеттеновы фигуры.
Происхождение: теллурическое (земное) железо редко встречается в базальтовых лавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в т.ч. и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов - железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
Семейство самородного железа (по Годовикову)
Группа самородного железа
< 2,9, редко до 6,4 ат. % Ni - феррит
< ~ 6,4 ат. % Ni - камасит
Группа самородного никеля
> 24 ат. % Ni - тэнит
62,5 - 92 ат. % Ni - аваруит Ni3Fe
(Ni, Fe) - Самородный никель
Железо (англ. Iron, франц. Fer, нем. Eisen) - один из семи металлов древности. Весьма вероятно, что человек познакомился с железом метеоритного происхождения раньше, чем с другими металлами. Метеоритное железо обычно легко отличить от земного, так как в нем почти всегда содержится от 5 до 30% никеля, чаще всего - 7-8%. С древнейших времен железо получали из руд, залегающих почти повсеместно. Наиболее распространенны руды гематита (Fe 2 O 3 ,), бурого железняка (2Fe 2 O 3 , ЗН 2 О) и его разновидностей (болотная руда, сидерит, или шпатовое железо FeCO3,), магнетита (Fe 3 0 4) и некоторые другие. Все эти руды при нагревании с углем легко восстанавливаются при сравнительно низкой температуре начиная с 500 o С. Получаемый металл имел вид вязкой губчатой массы, которую затем обрабатывали при 700-800 o С повторной проковкой.
В древности и в средние века семь известных тогда металлов сопоставляли с семью планетами, что символизировало связь между металлами и небесными телами и небесное происхождение металлов. Такое сопоставление стало обычным более 2000 лет назад и постоянно встречается в литературе вплоть до XIX в. Во II в. н. э. железо сопоставлялось с Меркурием и называлось меркурием, но позднее его стали сопоставлять с Марсом и называть марс (Mars), что, в частности, подчеркивало внешнее сходство красноватой окраски Марса с красными железными рудами.
Свойства минерала
- Происхождение названия: Обозначение химического элемента - от латинского ferrum, Iron – от староанглийского слова, означавшего этот металл
- Место открытия: Qeqertarsuaq Island (Disko Island), Qaasuitsup, Greenland
- Год открытия: известен с древних времён
- Термические свойства: П. тр. Точка плавления (чистого железа) 1528°С
- IMA статус: действителен, описан впервые до 1959 (до IMA)
- Типичные примеси: Ni,C,Co,P,Cu,S
- Strunz (8-ое издание): 1/A.07-10
- Hey"s CIM Ref.: 1.57
- Dana (7-ое издание): 1.1.17.1
- Молекулярный вес: 55.85
- Параметры ячейки: a = 2.8664Å
- Число формульных единиц (Z): 2
- Объем элементарной ячейки: V 23.55 ų
- Двойникование: по {111}
- Точечная группа: m3m (4/m 3 2/m) - Hexoctahedral
- Пространственная группа: Im3m (I4/m 3 2/m)
- Отдельность: по (112)
- Плотность (расчетная): 7.874
- Плотность (измеренная): 7.3 - 7.87
- Тип: изотропный
- Цвет в отраженном свете: белый
- Форма выделения: Форма кристаллических выделений:плотные зерна с неправильными извилистыми очертаниями, плёнки, дендриты, изредка самородки.
- Классы по систематике СССР: Металлы
- Классы по IMA: Самородные элементы
- Химическая формула: Fe
- Сингония: кубическая
- Цвет: Стально-серый, серо-черный, на полированной поверхности белый
- Цвет черты: Серо-черный
- Блеск: металлический
- Прозрачность: непрозрачный
- Спайность: несовершенная по {001}
- Излом: крючковатый занозистый
- Твердость: 4 5
- Микротвердость: VHN100=160
- Ковкость: Да
- Магнитность: Да
- Литература: Зарицкий П.В., Довгополов С.Д., Самойлович Л.Г. Состав и генезис рудопроявления самородного железа г. Озёрной в бассейне р. Курейки. - Вестник Харьковского ун-та, 1986, №283 (Средняя Сибирь) Мельцер М.А. и др. Самородное железо в золотонсных жилах Аллах-Юньского района и некоторые вопросы их генезиса. - Новые данные по геологии Якутии. Я., 1975, с. 74-78
Фото минерала
Статьи по теме
- Железо - один из семи металлов древности.
Весьма вероятно, что человек познакомился с железом метеоритного происхождения раньше, чем с другими металлами
Месторождения минерала Железо
- Красноярский край
- Россия
- Кугда, Хатанга, Таймыр.
 Железная руда Физические свойства железной руды
Железная руда Физические свойства железной руды Маршал авиации иван никитович кожедуб Иван кожедуб награды
Маршал авиации иван никитович кожедуб Иван кожедуб награды Эмма мошковская - обида Эмма мошковская обида
Эмма мошковская - обида Эмма мошковская обида