Примеры альдегидов. Альдегиды и кетоны — номенклатура, получение, химические свойства. Строение альдегидов и кетонов
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.
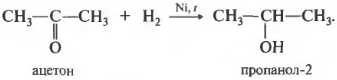
У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.

Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты , наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.

В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.

Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO 2 , проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Органические ЛС
Мы изучаем ЛС, поделенные на группы в соответствии с химической классификацией. Достоинством этой классификации является возможность выявления и исследования общих закономерностей при разработке методов получения препаратов, составляющих группу, методов фармацевтического анализа, основанных на физических и химических свойствах веществ, установления связи между химической структурой и фармакологическим действием.
Все ЛВ делятся на неорганические и органические. Неорганические, в свою очередь, классифицируются в соответствии с положением элементов в ПС. А органические – делятся на производные алифатического, алициклического, ароматического и гетероциклического ряда, каждый из которых подразделяется по классам: углеводороды, галогенпроизводные углеводородов, спирты, альдегиды, кетоны, кислоты, эфиры простые и сложные и т.д.
АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ, КАК ЛС.
Препараты альдегидов и их производных. Углеводы
Альдегиды
К этой группе соединений относятся органические лекарственные вещества, содержащие альдегидную группу, или их функциональные производные.
Общая формула:
Фармакологические свойства
Введение альдегидной группы в структуру органического соединения сообщает ему наркотическое и антисептическое действие. В этом действие альдегидов сходно с действием спиртов. Но в отличие от спиртовой, альдегидная группа усиливает токсичность соединения.
Факторы влияния строения на фармакологическое действие :
удлинение алкильного радикала повышает активность, но одновременно растет токсичность;
такой же эффект имеет введение непредельной связи и галогенов;
к снижению токсичности приводит образование гидратной формы альдегида. Но способность к образованию устойчивой гидратной формы проявляется только у хлорпроизводных альдегидов. Так, формальдегид является протоплазматическим ядом, используется для дезинфекции, уксусный альдегид и хлораль не применяются в медицине из-за высокой токсичности, а хлоралгидрат – ЛС, применяется как снотворное, успокоительное.
Сила наркотического (фармакологического) действия и токсичность росли от формальдегида к ацетальдегиду и хлоралю. Образование гидратной формы (хлоралгидрат) позволяет резко снизить токсичность, сохранив фармакологический эффект.
По физическому состоянию альдегиды могут быть газообразными (низкомолекулярные), жидкостями и твердыми веществами . Низкомолекулярные имеют резкий неприятный запах, высокомолекулярные – приятный цветочный.
Химические свойства
В химическом отношении это высоко реакционноспособные вещества, что обусловлено наличием в их молекуле карбонильной группы.
Высокая реакционная способность альдегидов объясняется:
а) наличием поляризованной двойной связи
б) дипольным моментом карбонила
в) наличием частичного положительного заряда на атоме углерода карбонила
σ -
σ + H
Двойная связь между С и О, в отличие от двойной связи между двумя углеродами, сильно поляризована, так как кислород обладает значительно большей электроотрицательностью, чем углерод, и электронная плотность π-связи смещается к кислороду. Такая высокая поляризация определяет электрофильные свойства углерода карбонильной группы и его способность реагировать с нуклеофильными соединениями (вступать в реакции нуклеофильного присоединения). Кислород группы обладает нуклеофильными свойствами.
Характерны реакции окисления и нуклеофильного присоединения
I. Реакции окисления.
Альдегиды легко окисляются . Окисление альдегидов до кислот происходит под влиянием как сильных, так и слабых окислителей .
Многие металлы – серебро, ртуть, висмут, медь, восстанавливаются из растворов их солей, особенно в присутствии щелочи. Это отличает альдегиды от других органических соединений, способных к окислению – спиртов, непредельных соединений, для окисления которых необходимы более сильные окислители. Следовательно, реакции окисления альдегидов комплексно связанными катионами ртути, меди, серебра в щелочной среде можно применять для доказательства подлинности альдегидов.
I. 1 .Реакция с аммиачным раствором нитрата серебра (реакция серебряного зеркала) рекомендуется ФС для подтверждения подлинности веществ с альдегидной группой.В основе окисление альдегида до кислоты и восстановление Ag + до Ag↓.
AgNO 3 + 2NH 4 OH → NO 3 +2H 2 O
НСОН + 2NO 3 + H 2 O → HCOONH 4 + 2Ag↓+ 2NH 4 NO 3 + NH 3
Формальдегид, окисляясь до аммонийной соли муравьиной кислоты, восстанавливает до металлического серебро, которое осаждается на стенках пробирки в виде блестящего налета «зеркала» или серого осадка.

I. 2. Реакция с реактивом Фелинга (комплексное соединение меди (II) с калий-натриевой солью винной кислоты). Альдегиды восстанавливают соединение меди (II) до оксида меди (I), образуется кирпично-красный осадок. Готовят перед употреблением).
реактив Феллинга 1 - раствор CuSO 4
реактив Феллинга 2 – щелочной раствор калий-натриевой соли винной кислоты
При смешавании 1:1 реактивов Феллинга 1 и 2 образуется синее комплексное соединение меди (II ) с калий-натриевой солью винной кислоты:

синее окрашивание
При добавлении альдегида и нагревании синее окрашивание реактива исчезает, образуется промежуточный продукт - желтый осадок гидроксида меди (I), сразу разлагающийся на красный осадок оксида меди (I) и воду.
2KNa +R - COH +2NaOH+ 2KOH→R - COONa +4KNaC 4 H 4 O 6 +2 CuOH ↓ +H 2 O
2 CuOH ↓ →Cu 2 O ↓ + H 2 O
Желтый осадок кирпично-красный осадок

В учебниках иная общая схема реакции
I. 3. Реакция с реактивом Несслера (щелочной раствор тетрайодмеркурат (II) калия). Формальдегид восстанавливает ион ртути до металлической ртути – осадок темно-серого цвета.
R-COH + K 2 +3KOH → R-COOK + 4KI + Hg ↓ + 2H 2 O
Альдегидами называются органические соединения, в которых карбонильная группа (С-О) связана с водородом и радикалом R (остатки алифатических, ароматических и гетероциклических соединений):
Полярность карбонильной группы обеспечивает полярность молекулы в целом, поэтому альдегиды имеют более высокие температуры кипения, чем неполярные соединения сравнимой молекулярной массы.
Поскольку атомы водорода в альдегидах связаны только с атомом углерода (близкие относительные электроотрицательности), межмолекулярные водородные связи не образуются. Поэтому температуры кипения альдегидов ниже, чем у соответствующих спиртов или карбоновых кислот. В качестве примера можно сравнить температуры кипения метанола (Т^ 65 °С), муравьиной кислоты (Гкип 101 °С) и формальдегида (7^, -21 °С).
Низшие альдегиды растворимы в воде, вероятно, вследствие образования водородных связей между молекулами растворенного вещества и растворителя. Высшие альдегиды хорошо растворяются в большинстве обычных органических растворителей (спирты, эфиры). Низшие альдегиды имеют резкий запах, у альдегидов с С3-С6 весьма неприятный запах, в то время как высшие альдегиды обладают цветочными запахами и применяются в парфюмерии.
В химическом отношении альдегиды - весьма реакционноспособные соединения. Наиболее характерны для альдегидов реакции нуклеофильного присоединения, что обусловлено присутствием в молекуле электрофильного центра - карбонильного атома углерода группы С=0.
Многие из этих реакций, например, образование оксимов, семикарбазонов и других соединений, используются в качественном и количественном анализе ЛС из группы альдегидов потому, что продукты присоединения альдегидов характеризуются определенной для каждого альдегида температурой плавления. Так, альдегиды при встряхивании с насыщенным раствором гидросульфита натрия легко вступают в реакцию присоединения:
Продукты присоединения представляют собой соли, имеющие определенную температуру плавления, хорошо растворимы в воде, но не растворимы в органических растворителях.
При нагревании с разбавленными кислотами гидросульфитные производные гидролизуются до исходных соединений.
Способностью альдегидов образовывать гидросульфитные производные пользуются как для определения подлинности препарата с альдегидной группой в молекуле, так и для очистки альдегидов и выделения их из смесей с другими веществами, не реагирующими с гидросульфитом натрия.
 |
|||||||||
Альдегиды также легко присоединяют аммиак и другие азотсодержащие нуклеофилы. Продукты присоединения обычно малоустойчивы и легко подвергаются дегидратации и полимеризации. Образующиеся в результате полимеризации циклические соединения при нагревании с разбавленными кислотами легко разлагаются, вновь освобождая альдегид:
| r-ch-nh2 | г з | -NH R-СС |
| -зн2о " | ||
| он |
Альдегиды легко окисляются. Оксид серебра(І) и другие окислители с невысоким значением окислительного потенциала способны окислять альдегиды. Например, для альдегидов характерна реакция образования серебряного зеркала, которая протекает с аммиачным раствором AgN03:
AgN03 + 3NH3 - OH + NH4N03
Реактив Толленса
При этом на стенках пробирки образуется зеркальный налет металлического серебра:
2OH + RCOH 2Agi + RCOOH + 4NH3T + Н20
Аналогично альдегиды могут восстанавливать медь(П) до меди(1). Для проведения реакции к раствору альдегида добавляют реактив Фелинга (щелочной раствор тартратного комплекса меди(П)) и нагревают. Сначала образуется желтый осадок гидроксида меди(1) - СиОН, а затем красный - оксида меди(1) - Си20:
2KNa + RCOH + 3NaOH + 2КОН -
2CuOHi + RCOONa + 4KNaC4H406 + 2H20 2CuOH - Cu20 + H20
К окислительно-восстановительным относится также реакция взаимодействия альдегидов с реактивом Несслера в щелочной среде; при этом выпадает темный осадок восстановленной ртути:
K2 + RCOH + ЗКОН - RCOOK + 4KI + Hgl + 2Н20
Следует иметь в виду, что реакция с реактивом Несслера более чувствительна, поэтому ее используют для обнаружения примесей альдегидов в ЛС. Подлинность лекарственных средств, содержащих альдегидную группу, подтверждают менее чувствительными реакциями: серебряного зеркала или с реактивом Фелинга. Некоторые другие соединения, например полифенолы, также окисляются соединениями Ag(I) и Си(П), т.е. реакция не является специфической.
Формальдегид и уксусный альдегид склонны к полимеризации. Формальдегид полимеризуется, образуя циклические тримеры, тетрамеры или линейные полимеры. Реакция полимеризации протекает в результате нуклеофильной атаки кислорода одной молекулы карбонильного атома углерода другой:
Так, из 40 % водного раствора формальдегида (формалина) образуется линейный полимер - параформ (и = 8 - 12), тример и тетрамер.
Для альдегидов характерны наркотические и дезинфицирующие свойства. По сравнению со спиртами альдегидная группа усиливает токсичность вещества. Введение галогена в молекулу альдегида повышает его наркотические свойства. Например, наркотические свойства хлораля более выражены, чем у уксусного альдегида:
![]() с!3с-сС
с!3с-сС
Получение. Альдегиды могут быть получены окислением первичных спиртов хромовой кислотой (Na2Cr04, H2S04) при кипячении или перманганатом калия в щелочной среде:
Дегидрирование первичных спиртов осуществляют над медным катализатором (Си, Сг203) при 300-400 °С.
Промышленное производство метаналя основано на парофазном окислении метанола с железомолибденовым катализатором:
2СН3ОН + 02 500 ~600 2СН2=0 + Н20
Раствор формальдегида (формалин)
Получение. Формалин - это водный раствор формальдегида (40 %), стабилизированный метанолом (6-10 %). Европейская Фармакопея содержит ФС «Формальдегида раствор (35 %)» (см. табл. 9.1). В лабораторных условиях формальдегид может быть получен дегидрированием метанола над медью или деполимеризацией параформа.
Определение подлинности. Фармакопейный способ - реакция серебряного зеркала.
Поскольку формальдегид легко вступает в реакции конденсации, например, с гидроксилсодержащими ароматическими соединениями с образованием окрашенных соединений, ГФ рекомендует также использовать для его идентификации реакцию с салициловой кислотой, в результате которой появляется красное окрашивание:
|
||||||||||
|
||||||||||
|
||||||||||
Аналогично протекает реакция с хромотроповой кислотой с образованием синефиолетовых и красно-фиолетовых продуктов (ЕФ).
Для определения подлинности фармальдегида могут быть использованы реакции с азотсодержащими нуклеофилами, например первичными аминами:
H-Ctf° + H2N-R - н-с^^К + Н20
Образующиеся N-замещенные имины (основания Шиффа) малорастворимы, некоторые из них окрашены, другие дают окрашенные соединения с ионами тяжелых металлов. ЕФ предлагает реакцию с фенилгидразином. В присутствии калия феррици- анида в кислой среде образуются продукты реакции интенсивно красного цвета.
Испытания на чистоту. Контроль примеси муравьиной кислоты осуществляют, определяя кислотность. Согласно ГФ, концентрация муравьиной кислоты в препарате не должна превышать 0,2 %; устанавливают содержание муравьиной кислоты методом нейтрализации (ГФ). Согласно ЕФ, метанол определяют методом газовой хроматографии (9-15 % об.). Сульфатная зола - не более 0,1 % в навеске 1,0 г.
I2 + 2NaOH - Nal + NaOI + Н20
Гипойодит окисляет формальдегид до муравьиной кислоты. Непрореагировавший гипойодит при подкислении раствора избытком серной кислоты превращается в йод, который оттитровывают тиосульфатом натрия:
НСОН + NaOI + NaOH - HCOONa + Nal + H20 NaOI + Nal + H2S04 -*■ I2 + Na2S04 + H20 I2 + 2Na2S203 - Na2S406 + 2NaI
Возможно использование и других титрующих агентов при определении формальдегида: водорода пероксида в щелочном растворе, церия(ІУ) сульфата, натрия сульфита.
Препарат можно рассматривать как пролекарство, так как физиологическое действие оказывает не сам гексаметилентетрамин, а формальдегид, выделяющийся при разложении препарата в кислой среде. Именно этим объясняется включение его в настоящий раздел (см. табл. 9.1).
Получение. Уротропин (тетраазаадамантан) получают конденсацией метаналя и аммиака из водных растворов. Промежуточный продукт реакции - гексагидро-1,3,5- триазин:
| ll Гексагидро- Уротропин 1,3,5-трназин |
Определение подлинности. При нагревании смеси препарата с разведенной серной кислотой образуется аммонийная соль, из которой при добавлении избытка щелочи выделяется аммиак:
(CH2)6N4 + 2H2S04 + 6Н20 - 6НСОН + 2(NH4)2S04 (NH4)2S04 + 2NaOH - 2NH3t + Na2S04 + 2H20
Гексаметилентетрамин можно обнаружить также по красному окрашиванию раствора при добавлении салициловой кислоты после предварительного нагревания с серной кислотой (см. определение подлинности формальдегида).
Испытания на чистоту. В препарате не допускается присутствие примесей органических соединений, параформа, солей аммония. ГФ указывает допустимые пределы содержания примесей хлоридов, сульфатов, тяжелых металлов.
Количественное определение. Для количественного определения гексаметилентетрамина ГФ предлагает использовать метод нейтрализации. Для этого навеску препарата нагревают с избытком 0,1М раствора серной кислоты. Избыток кислоты оттитровы- вают раствором щелочи концентрацией 0,1 моль/л (индикатор метиловый красный).
На способности гексаметилентетрамина давать с йодом тетрайодиды основан йодометрический метод количественного определения.
Нахождение в природе
Альдегидная группа содержится во многих природных веществах, таких, как углеводы (альдозы), некоторые витамины (ретиналь, пиридоксаль). Их следы содержатся в эфирных маслах и часто способствуют их приятному запаху, например, коричный альдегид (в кассиевом масле его может быть до 75 %, а в цейлонском коричном масле даже до 90 %) и ванилин.
Алифатический альдегид СН3(СН2)7С(Н)=О (тривиальное название - пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизаторотщепление.
Цитраль содержится в лемонграссовом и кориандровом маслах (до 80 %), цитронеллаль - в цитронелловом (приблизительно 30 %) и эвкалиптовом, бензальдегид - в масле горького миндаля. Куминовый альдегид содержится в масле тмина, гелиотропин - в масле гелитропа и сирени, анисовый альдегид и жасминальдегид в небольших количествах содержатся во многих эфирных маслах.отщеплениеотщепление.
Процесс получения ацетальдегида, основанный на гидратации ацетилена, в последнее время потерял былое значение. Последние фабрики в Западной Европе, синтезирующие ацетальдегид по данной схеме, были закрыты в 1980 году. Причиной этому послужила бо́льшая доступность этилена в качестве сырья, а также токсичность катализатора - сульфата ртути.
Ежегодное мировое производство формальдегида (по данным на 1996 год) составило 8,7·106 т, ацетальдегида (на 2003 год) - 1,3·106 т.
Основным методом получения бензальдегида является гидролиз бензальхлорида в кислой или щелочной средах. В качестве гидролизующих агентов могут применяться гидроксид кальция, карбонат кальция, гидрокарбонат натрия, карбонат натрия, а также различные кислоты с добавлением солей металлов. Исходное сырьё, в свою очередь, получают при хлорировании толуола в боковую цепь. Менее распространённый процесс основан на частичном окислении толуола.
Физические свойства альдегидов
Формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды до С12 - жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом, являются твёрдыми веществами.
Температуры кипения альдегидов с неразветвлённым строением углеродной цепи выше, чем у их изомеров. Например, валериановый альдегид кипит при 100,4 °C, а изовалериановый - при 92,5 °C. Они кипят при более низких температурах, чем спирты с тем же числом углеродных атомов, например, пропионовый альдегид кипит при 48,8 °C, а пропанол-1 при 97,8 °C. Это показывает, что альдегиды, в отличие от спиртов, не являются сильно ассоциированными жидкостямиотщепление. Данное свойство используется в синтезе альдегидов путём восстановления спиртов: поскольку температура кипения альдегидов в целом ниже, они могут быть легко отделены и очищены от спирта перегонкой. В то же время их температуры кипения намного выше, чем у углеводородов с той же молекулярной массой, что связано сих высокой полярностьюотщепление.
Вязкость, плотность и показатель преломления при 20 °C увеличиваются с увеличением молярной массы альдегидов. Низшие альдегиды являются подвижными жидкостями, а альдегиды от гептаналя до ундеканаля имеют маслообразную консистенцию.
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается, например, растворимость гексаналя при 20 °С составляет лишь 0,6 % по массе. Алифатические альдегиды растворимы в спиртах, простых эфирах и других распространённых органических растворителях.
Низшие альдегиды имеют резкий запах, а высшие гомологи от С8 до С13 являются компонентами многих парфюмерных изделий.
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации. Углы R-C-H, R-C-O и H-C-O составляют приблизительно 120° (где R - алкил).
Двойная связь карбонильной группы сходна по физической природе с двойной связью между углеродными атомами, однако в то же время энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых связей (2×358 кДж/моль) C-O. С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы составляет ~9·10−30 Кл·мотщепление. Длина связи С=О составляет 0,122 нм.
Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры:
Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов как выраженных электрофилов и позволяет им вступать в многочисленные реакции нуклеофильного присоединения.
Подобным образом протекает и реакция присоединения спиртов по карбонильной группе, имеющая важное значение в органическом синтезе для защиты карбонильной группы. Первичный продукт присоединения называется полуацеталем, далее под действием кислоты он превращается в ацеталь. При стоянии альдегиды также образуют циклические или полимерные ацетали (например, триоксан или параформ для формальдегида и паральдегид для ацетальдегида). При нагревании этих соединений со следовыми количествами кислот происходит деполимеризация и регенерация исходных альдегидов.
Аналогичные превращения происходят также с участием серосодержащих аналогов спиртов - тиолов; они приводят, соответственно, к тиоацеталям, также играющим важную роль в тонком органическом синтезе.
Альдегиды могут присоединять циановодород HCN с образованием циангидринов, применяемых в органическом синтезе для получения α,β-ненасыщенных соединений, α-гидроксикислот, α-аминокислот. Данная реакция также является обратимой и катализируется основаниями. В лабораторных условиях циановодород (т. кип. 26 °C) обычно получают действием эквивалентного количества минеральной кислоты на цианид натрия или калия.
Относительно небольшие пространственные затруднения при присоединении нуклеофилов к альдегидам позволяют превращать их в бисульфитные производные под действием большого избытка гидросульфита натрия NaHSO3. Данные соединения представляют собой кристаллические вещества и часто используются для выделения, очистки или хранения соответствующих альдегидов, поскольку последние могут быть легко из них регенерированы под действием кислоты или основания.
Реакция альдегидов с магний- и литийорганическими соединениями приводит к образованию вторичных спиртов (в случае формальдегида - первичных). Процесс может осложняться побочными реакциями енолизации и восстановления карбонильного соединения, которые приводят к снижению выхода. При использовании литийорганических соединений эти помехи удаётся устранить.
При реакции альдегидов с первичными и вторичными аминами происходит образование иминов и енаминов соответственно. В основе обеих реакций лежит присоединение нуклеофильных реагентов по карбонильной группе с последующим отщеплением воды от полученного тетраэдрического интермедиата. Реакция образования иминов требует кислотного катализа и наиболее эффективно протекает в области pH от 3 до 5. Для получения енаминов с удовлетворительным выходом необходимо применять азеотропную отгонку воды, что позволяет сместить равновесие в сторону образования продукта. Обычно в качестве вторичных аминов используют циклические амины (пирролидин, пиперидин или морфолин).
Аналогичным образом альдегиды реагируют с гидроксиламином, гидразином, 2,4-динитрофенилгидразином, семикарбазидом и другими подобными соединениями. Большинство получаемых при этом соединений являются кристаллическими и могут быть использованы для идентификации альдегидов по температуре плавления и другим характеристикам. Также эти соединения находят применение в органическом синтезе, например, гидразоны могут быть восстановлены по реакции Кижнера - Вольфа.
Присоединение к α,β-ненасыщенным альдегидам может протекать с образованием 1,2- и 1,4-продуктов
Присоединение нуклеофильных реагентов к α,β-ненасыщенным альдегидам может протекать как по карбонильной группе, так и по «четвёртому» положению сопряжённой системы. Причина этого заключается в том, что двойная углерод-углеродная связь поляризуется под действием полярной карбонильной группы (мезомерный эффект), и дальний от карбонильной группы атом углерода двойной связи приобретает частичный положительный заряд. Реакция нуклеофила с данным атомом углерода называется сопряжённым присоединением, или 1,4-присоединением. Присоединение к карбонильной группе по аналогии называют 1,2-присоединением. Формальным результатом 1,4-присоединения является присоединение нуклеофила по углерод-углеродной двойной связи. Во многих случаях 1,2- и 1,4-присоединение являются конкурирующими реакциями, однако иногда удаётся проводить селективные реакции с получением продуктов 1,2- либо 1,4-присоединения.
Присоединение первичных и вторичных аминов к α,β-ненасыщенным альдегидам протекает в мягких условиях и приводит к образованию 1,4-продукта. Напротив, в случае циановодорода наблюдается конкурентное образование обоих продуктов с преобладанием продукта 1,2-присоединения. Чтобы в данной реакции исключить возможность 1,2-присоединения, используют специальный реагент - диэтилалюминийцианид (C2H5)2AlCN.
Литийорганические соединения присоединяются исключительно по карбонильной группе, давая аллиловые спирты. Сопряжённое присоединение проводят под действием медьорганических реагентов - диалкилкупратов, которые позволяют ввести в карбонильное соединение не только первичную, но также вторичную или третичную алкильную, алкенильную или арильную группу. Магнийорганические реагенты (реактивы Гриньяра), полученные из магния сверхвысокой чистоты, также присоединяются с образованием 1,2-продуктов, в то время как обыкновенные реактивы Гриньяра, предположительно из-за примесей других металлов (например, меди и железа) вступают и в 1,2-, и в 1,4-присоединение, что регулируется пространственными факторами. В настоящее время магнийорганические реагенты утратили своё значение в данной области.
Благодаря способности образовывать енолят-ионы альдегиды вступают в ряд химических реакций, где эти частицы выступают как нуклеофилы. В частности, для них характерны реакции конденсации. В слабоосновной среде (в присутствии ацетата, карбоната или сульфита калия) подвергаются альдольной конденсации, в ходе которой часть молекул альдегида выступает как карбонильная компонента (реагирует карбонильной группой), а часть молекул альдегида под действием основания превращается в енолят-ионы и выступает как метиленовая компонента (вступает в реакцию α-метиленовым звеном). Образующийся альдоль при нагревании отщепляет воду с образованием α,β-непредельного альдегида (переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией или альдольно-кротоновой конденсацией).
При реакции между двумя разными альдегидами образуется смесь четырёх различных альдолей. Исключение составляют случаи, когда разделение реагентов на карбонильную и метиленовую компоненту очевидно (например, один из альдегидов не содержит α-метиленового звена и может выполнять роль только карбонильной компоненты). Разработаны также методы повышения селективности подобных реакций. Перекрёстная конденсация ароматических альдегидов с кетонами, получила название реакции Кляйзена - Шмидта. Известны также схожие реакции альдегидов: реакция Кнёвенагеля, реакция Тищенко, реакция Перкина, бензоиновая конденсация и другиеотщепление.
Ароматические альдегиды также окисляются до карбоновых кислот или сложных эфиров фенолов (реакция Байера - Виллигера) под действием надкислот, причём соотношение продуктов зависит как от заместителей в ароматическом ядре, так и от кислотности среды.
Альдегиды можно восстанавливать до первичных спиртов. Наиболее распространённые методы восстановления включают реакции с комплексными гидридами: боргидридом натрия NaBH4, боргидридом лития LiBH4 и алюмогидридом лития LiAlH4. Боргидрид натрия является более избирательным реагентом и позволяет восстанавливать карбонильную группу альдегидов и кетонов, не затрагивая сложноэфирные, нитрильные, амидные, лактонные и оксирановые группы. Он также не восстанавливает изолированную двойную углерод-углеродную связь. Алюмогидрид лития менее селективен и восстанавливает перечисленные выше функциональные группы, поэтому восстановление альдегидов с его применением возможно только в отсутствие этих групп.
Историческую роль играет реакция Меервейна - Пондорфа - Верлея, в которой в качестве восстановителя используется изопропилат алюминия. В настоящее время этот метод вытеснен более эффективной реакцией восстановления альдегидов и кетонов изопропиловым спиртом в присутствии окиси алюминия.
Алифатические альдегиды обычно не гидрируют на палладиевых катализаторах, но для этих целей можно использовать рутений на угле, никель Ренея или платину.
В аналитической практике используется окисление альдегидов и кетонов йодом в щелочной среде. Йод добавляют в избытке, а затем избыток его оттитровывают тиосульфатом натрия.
Спектральные методы анализа альдегидовов.
ИК-спектроскопические методы анализа альдегидовотщепление
Альдегиды легко идентифицировать по ИК-спектру - он содержит специфические полосы поглощения, относящиеся к валентным колебаниям связи C-H в альдегидной группе: два острых пика, расположенные далеко за пределами области поглощения, характерной для связей C-H обычного типа. Кроме того, в ИК-спектрах альдегидов обычно присутствуют полосы поглощения, обусловленные валентными колебаниями связей С=O и C-H: νС=O=1725-1685 см−1, νС-H=2850; 2750 см−1.
Масс-спектрометрические методы анализа альдегидовотщепление
Масс-спектры альдегидов имеют довольно выраженный молекулярный ион, хотя его содержание может быть довольно низким. Потеря алкильных радикалов приводит к образованию ацил-катионов. Для них особенно характерны α- и β-расщепление и перегруппировка Мак-Лафферти. Для альдегидов с подвижным γ-атомом H и не содержащих заместителя у α-углерода характерен пик m/z=44, а для содержащих заместитель появляется интенсивный пик замещённого иона с m/z=44+12nотщепление.
ЯМР-спектроскопические методы анализа альдегидовотщепление
В 1Н ЯМР-спектре альдегида наиболее характеристичным является сигнал формильного протона, обычно расположенный в наиболее слабом поле в области δ 9,4-10,1 м д. (9,4-9,7 -алифатические, 9,6-10,1 -ароматические)отщепление. Сигнал альдегидной группы в 13C ЯМР-спектре расположен в области 182-215 м д.
УФ-спектроскопические методы анализа альдегидовотщепление
Два максимума поглощения от р до р* (<200 нм) и от n до р* (> 200 нм).
Электронно-спектроскопические методы анализа альдегидовотщепление
Электронные спектры содержат полосы с λмакс 290 нм для RCHO (R=CH3, C2H5, C3H7), 345 нм для акролеина и 327 для кротонового альдегидаотщепление.
Биологическое действие
Токсичны. Способны накапливаться в организме. Кроме общетоксического, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Ацетальдегид СН3СНО вызывает возбуждение, сменяющееся наркозом. Он является промежуточным продуктом метаболизма этилового спирта в организме. Действие тримера этого альдегида - паральдегида (С2Н40)3 - сильнее и продолжительнее, в то время как тетрамер - метальдегид (С2Н40)4 - является более токсичным. Удлинение алкильного радикала в молекуле альдегида приводит к усилению физиологической активности, но вместе с этим возрастает и токсичность.
Введение галогена в молекулу альдегида повышает его наркотическое (снотворное) действие. Так, наркотические свойства хлораля более выражены, чем у ацетальдегида. Альдегидная группа усиливает токсичность вещества, но она может быть значительно снижена путем образования гидратной формы альдегида. Гидратные формы мало токсичны, в такой форме хлораль применяется в медицине под названием хлоралгидрата, проявляющего снотнорное действие. Введение гидроксильных групп в молекулу альдегида или конденсация их с образованием альдолей существенно снижает реакционную способность, а также физиологическую активность соединений. Так, сахара представляют собой фармакологически инертные вещества. Большинство ароматических альдегидов имеет низкую токсичность, так как они легко окисляются до соответствующих кислот, которые обычно довольно инертныотщепление
Из всех альдегидов больше всего производится формальдегида (около 6 млн тонн/год). Он, в основном, используется в производстве смол - бакеллита, галалита (в сочетании с мочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок). Он является предшественником метилендифенилдиизоцианата, использующегося в производстве полиуретанов и гексогена (довольно сильной взрывчатки).
Второй по масштабам производства альдегид - масляный альдегид (получают около 2,5 млн тонн/год методом гидроформилирования). Некоторые альдегиды синтезируют только в небольших масштабах (менее 1000 тонн / год) и используют в качестве ингредиентов в парфюмерии и ароматов (в основном альдегиды с числом атомов карбона от 8 до 12)отщепление. Например, это коричный альдегид и его производные - цитраль и лилиаль.
Ацетальдегид используется для синтеза уксусной кислоты, этилового спирта, бутадиена для получения производных пиридина, пентаэритрита и кротонового альдегида, а также при синтезе поливинилацетата и пластмасс.
Альдегиды применяют для синтеза спиртов (бутиловых, 2-этилгексанола, пентаэритрита), карбоновых кислот, полимеров, антиоксидантов, пиридиновых основанийотщепление.
Список литературы:
1. http://intranet.tdmu.edu.ua/data/kafedra/internal/distance/lectures_stud/русский/1%20курс/Медицинская%20химия/06.%20Карбонильные%20соединения.%20Альдегиды%20и%20кетоны%20Карбоновые%20кислоты.Липиды..htm
Строение альдегидов и кетонов

Альдегиды - органические вещества, молекулы которых содержат карбонильную группу :

соединенную с атомом водорода и углеводородным радикалом. Общая формула альдегидов имеет вид:

В простейшем альдегиде - роль углеводородного радикала играет другой атом водорода:
 Формальдегид
Формальдегид
Карбонильную группу, связанную с атомом водорода, часто называют альдегидной :

Кетоны - органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Очевидно, общая формула кетонов имеет вид:

Карбонильную группу кетонов называют кето-группой .
В простейшем кетоне - ацетоне - карбонильная группа связана с двумя метильными радикалами:

Номенклатура и изомерия альдегидов и кетонов
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды :
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода с молекуле с помощью суффикса -аль . Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи).
Например:
Для альдегидов характерен только один вид структурной изомерии - изомерия углеродного скелета , которая возможна с бутаналя, а для кетонов - также и изомерия положения карбонильной группы . Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Физические свойства альдегидов и кетонов

В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь С=O сильно поляризована за счет смещения электронной плотности π-связи к кислороду:

Альдегиды и кетоны - полярные вещества с избыточной электронной плотностью на атоме кислорода . Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей.
Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
1. Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:

Продуктом гидрирования альдегидов являются первичные спирты, кетонов - вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона - пропанол-2.

2. Гидрирование альдегидов - реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:

1. Окисление кислородом воздуха. Например, из пропионового альдегида (пропаналя) образуется пропионовая кислота:

2. Окисление слабыми окислителями (аммиачный раствор оксида серебра). В упрощенном виде этот процесс можно выразить уравнением реакции:

Например:

Более точно этот процесс отражают уравнения:

Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
3. Окисление свежеосажденным гидроксидом меди (II). Окисляя альдегид, Cu 2+ восстанавливается до Cu + . Образующийся в ходе реакции гидроксид меди (I) CuOH сразу разлагается на оксид меди (I) красного цвета и воду.

Эта реакция, так же как и реакция «серебряного зеркала », используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Химические свойства альдегидов и кислот - конспект


Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид HCHO) - бесцветный газ с резким запахом и температурой кипения -21 °С, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде (40 %) называют формалином и применяют для формальдегид и уксусной дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности - для обработки кож. Формальдегид используют для получения уротропина - лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид CH 3 CHO) - жидкость с резким, неприятным запахом и температурой кипения 21 °С, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит !

Группа атомов -

Называется карбоксильной группой , или карбоксилом.
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными .
Общая формула этих кислот RCOOH, например:

Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными . К ним относятся, например, щавелевая и янтарная кислоты:

Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:

В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические .
Предельными , или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:

или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат π-связей в углеводородном радикале.
В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой)
СН 2 =СН-СООН
или олеиновой
СН 3 -(СН 2) 7 -СН=СН-(СН 2) 7 -СООН
и других кислот.
Как видно из формулы бензойной кислоты, она является ароматической , так как содержит в молекуле ароматическое (бензольное) кольцо:


Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов — , окончания -ая и слова кислота . Нумерация атомов углерода начинается с карбоксильной группы . Например:

Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра- :
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Состав предельных одноосновных карбоновых кислот будет выражаться общей формулой С n Н 2n O 2 , или С n Н 2n+1 СOOН , или RСООН .
Физические свойства карбоновых кислот
Низшие кислоты, т. е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, - жидкости с характерным резким запахом (например, запах уксусной кислоты). Кислоты, содержащие от 4 до 9 атомов углерода, - вязкие маслянистые жидкости с неприятным запахом; содержащие более 9 атомов углерода в молекуле - твердые вещества, которые не растворяются в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, температура кипения муравьиной кислоты равна 100,8 °С, уксусной - 118 °С, пропионовой - 141 °С.
Простейшая карбоновая кислота - муравьиная НСООН, имея небольшую относительную молекулярную массу (М r (НСООН) = 46), при обычных уcловиях является жидкостью с температурой кипения 100,8 °С. В то же время бутан (M r (C 4 H 10) = 58) в тех же условиях газообразен и имеет температуру кипения -0,5 °С. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот , в которых две молекулы кислоты связаны двумя водородными связями :

Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов - карбоксил

И практически неполярный углеводородный радикал . Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи:

Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства карбоновых кислот
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их - слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т. е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами , стоящими в электрохимическом ряду напряжений до водорода:
Так, железо восстанавливает водород из уксусной кислоты:
3. Взаимодействие с основными оксидами с образованием соли и воды:
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:

6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров - реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:

Очевидно, что реагировать с карбоновыми кислотами, т. е. вступать в реакцию этерификации, могут и многоатомные спирты, например, глицерин:

Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи - в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода - гидрирование. Для кислоты, содержащей в радикале одну л-связь, можно записать уравнение в общем виде:
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:

8. Реакции замещения (с галогенами) - в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:

Химические свойства карбоновый кислот - конспект



Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота HCOOH - жидкость с резким запахом и температурой кипения 100,8 °C, хорошо растворима в воде.
Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту.
Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленностях, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота CH 3 COOH - бесцветная жидкость с характерным резким запахом, смешивается с водой в любых отношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса (3-5 % -й раствор) и уксусной эссенции (70-80 %-й раствор) и широко используются в пищевой промышленности. Уксусная кислота - хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, - гербициды. Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая C 15 H 31 COOH и стеариновая C 17 H 35 COOH кислоты . В отличие от низших кислот эти вещества твердые, плохо растворимы в воде.
Однако их соли - стеараты и пальмитаты - хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах.
Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота C 17 H 33 COOH, или CH 3 - (CH 2) 7 - CH = CH -(CH 2) 7 COOH. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота HOOC-COOH, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота - это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленностях.
Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости


 Методика работы со схемами предложений на уроках русского языка в начальных классах
Методика работы со схемами предложений на уроках русского языка в начальных классах Чжан хань и его девушка. Чжан хань. Смотреть что такое "Чжан Хань" в других словарях
Чжан хань и его девушка. Чжан хань. Смотреть что такое "Чжан Хань" в других словарях Высшее военное училище летчиков
Высшее военное училище летчиков