Опыты э резерфорда по изучению. Опыты резерфорда по рассеянию альфа-частиц. Причина, по которой отклонялись альфа-частицы
Строение атома является сложным. Это подтверждают открытия таких явлений, как электрон, рентгеновские лучи и радиоактивность. В результате теоретических исследований и многочисленных опытов была построена теория строения атома . Особенно важный вклад в создание теории строения атома внёс английский физик Эрнест Резерфорд (1871 – 1937), который проводил опыты по изучению прохождения альфа-частиц через тонкие металлические пластины золота и платины.
Резерфорд в 1906 году предложил провести зондирование атомов тяжёлых элементов альфа-частиц с энергией 4,05 МэВ, которые испускались ядром урана или радия. Таким образом предлагалось изучить рассеяние (изменение направления движения) альфа-частиц в веществе.
Масса альфа-частицы примерно в 8000 раз больше массы электрона. Положительный заряд равен по модулю удвоенному заряду электрона 2е. Скорость альфа-частицы составляет 1/15 скорости света или 2 * 10 7 м/с. Альфа-частица – это полностью ионизированный атом гелия.
Упрощенная схема опытов Резерфорда изображена на рис. 1.1. Альфа-частицы испускались радиоактивным источником 1, помещённым внутри свинцового цилиндра 2 с узким каналом 3. Узкий пучок альфа-частиц из канала падал на фольгу 4 из исследуемого материала, перпендикулярно к поверхности фольги. Из свинцового цилиндра альфа-частицы проходили только через канал, а остальные поглощались свинцом. Прошедшие сквозь фольгу и рассеянные ею альфа-частицы попадали на полупрозрачный экран 5, который был покрыт люминесцирующим веществом (сульфатом цинка). Это вещество было способно светиться при ударе об него альфа-частицы. Столкновение каждой частицы с экраном сопровождалось вспышкой света. Эта вспышка называется сцинтилляция (от латинского scintillation – сверкание, кратковременная вспышка света). За экраном находился микроскоп 6. Чтобы не происходило дополнительного рассеяния альфа-частиц в воздухе, весь прибор размещался в сосуде с достаточным вакуумом.
Рис. 1.1. Упрощённая схема опытов Резерфорда.
В отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком альфа-частиц. Но когда на пути движения альфа-частиц помещали тонкую золотую фольгу толщиной примерно 0,1 мк (микрон), то наблюдаемая на экране картинка сильно менялась: отдельные вспышки появлялись не только за пределами прежнего кружка, но их можно было даже наблюдать с противоположной стороны золотой фольги.
Подсчитывая число сцинтилляций в единицу времени в разных местах экрана, можно установить распределение в пространстве рассеянных альфа-частиц. Число альфа-частиц быстро убывает с увеличением угла рассеяния.
Наблюдаемая на экране картина позволила заключить, что большинство альфа-частиц проходит сквозь золотую фольгу без заметного изменения направления их движения. Однако некоторые частицы отклонялись на большие углы от первоначального направления альфа-частиц (порядка 135 о …150 о) и даже отбрасывались назад. Исследования показали, что при прохождении альфа-частиц сквозь фольгу примерно на каждые 10000 падающих частиц только одна отклоняется на угол более 10 о от первоначального направления движения. Лишь в виде редкого исключения одна из огромного числа альфа-частиц отклоняется от своего первоначального направления.
Тот факт, что многие альфа-частицы проходили сквозь фольгу, не отклоняясь от своего направления движения, говорит о том, что атом не является сплошным образованием. Так как масса альфа-частицы почти в 8000 раз превосходит массу электрона, то электроны, входящие в состав атомов фольги, не могут заметно изменить траекторию альфа-частиц. Рассеяние альфа-частиц может вызывать положительно заряженная частица атома – атомное ядро.
Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и почти весь положительный заряд атома.
Чем ближе альфа-частица подходила к ядру, тем больше была сила электрического взаимодействия и тем на больший угол частица отклонялась. На малых расстояниях от ядра положительно-заряженная альфа-частица испытывает значительную силу отталкивания F от ядра, которую определяют по закону Кулона:
| F = |
где r – расстояние от ядра до альфа-частицы; ε 0 – электрическая постоянная в единицах измерения СИ; p – число протонов в ядре; е = 1,6*10-19 Кл – абсолютное значение элементарного электрического заряда (заряда электрона); 2e – заряд альфа-частицы
На рисунке 1.2 показаны траектории альфа-частиц, пролетающих на различных расстояниях от ядра.
Резерфорд смог ввести формулу, связывающую количество рассеянных на определённый угол альфа-частиц с энергией альфа-частиц и протонов р в ядре атома. Опытная проверка формулы подтвердила её справедливость и показала, что количество протонов в ядре равно числу внутриатомных электронов Z и определяется атомным номером химического элемента (то есть порядковым номером элемента в периодической системе Д.И.Менделеева):
p = Z
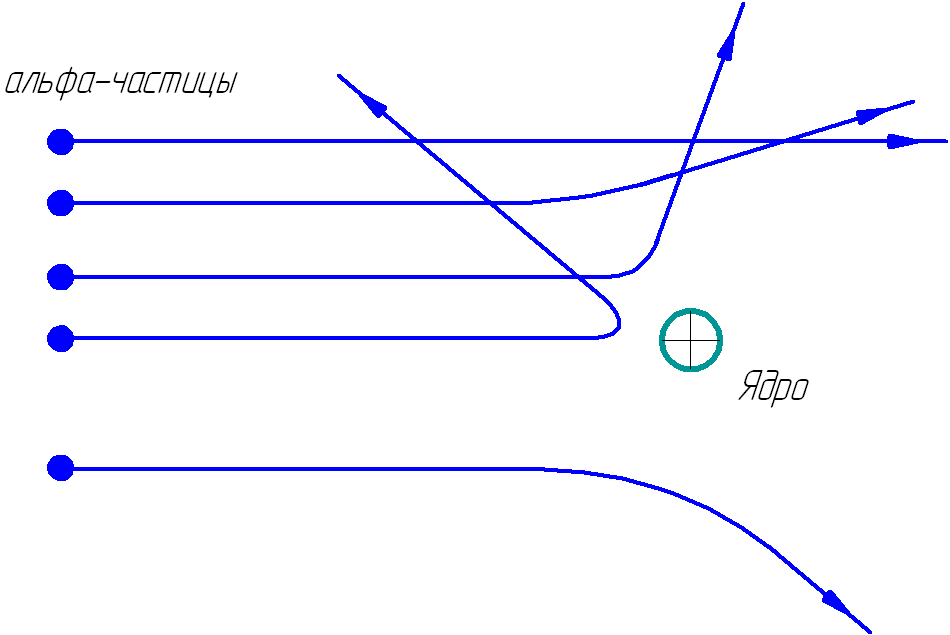
Рис. 1.2. Траектории альфа-частиц.
Подсчитывая количество альфа-частиц, рассеянных на различные углы, Резерфорд смог оценить линейные размеры ядра. Чтобы положительное ядро могло отбросить альфа-частицу назад, потенциальная энергия электростатического (кулоновского) отталкивания у границ ядра атома должна равняться кинетической энергии альфа-частицы:
| = |
Оказалось, что ядро имеет диаметр:
D я = 10 -13 …10 -12 см = 10 -15 …10 -14 м
Линейный диаметр самого атома:
D a = 10 -8 см = 10 -10 м
Планетарная модель атома
После анализа многочисленных опытов, Резерфордом в 1911 году была предложена планетарная модель атома (ядерная модель атома).
Согласно этой модели в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Вокруг ядра вращаются по орбитам отрицательно заряженные электроны. Электроны движутся вокруг ядра на относительно больших расстояниях, подобно тому, как планеты вращаются вокруг солнца. Из совокупности этих электронов образуется электронная оболочка или электронное облако .
Атом в целом нейтрален, следовательно, абсолютное значение суммарного отрицательного заряда электронов равно положительному заряду ядра: число Z*e протонов в ядре равно числу электронов в электронном облаке и совпадает с порядковым номером (атомным номером) Z атома данного химического элемента в периодической системе Д.И.Менделеева.
Например, атом водорода имеет порядковый номер Z = 1, следовательно, атом водорода состоит из положительного ядра с зарядом, равным абсолютному значению заряда электрона. Вокруг ядра вращается один электрон. Ядро атома водорода названо протоном. Атом лития имеет порядковый номер Z = 3, следовательно, вокруг ядра атома лития вращаются 3 электрона.
Первая попытка создания модели атома на основе накопленных экспериментальных данных (1903 г.) принадлежит Дж. Томсону. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом, примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис. 6.1.1). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
Рисунок 6.1.1.
Модель атома Дж. Томсона
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.

Рисунок 6.1.2.
Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находилbcm в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона возросла бы в n 2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. Рис. 6.1.3 иллюстрирует рассеяние α-частицы в атоме Томсона и в атоме Резерфорда.
Выводы из опыта по рассеиванию альфа-частиц Резерфорда: 1. Существует атомное ядро, т.е. тело малых размеров, в котором сконцентрирована почти вся масса атома и весь положительный заряд. 2. В ядре сконцентрирована почти вся масса атома. 3. Вокруг ядра по замкнутым орбитам вращаются отрицательные частицы- электроны. 4. отрицательный заряд всех электронов распределён по всему объёму атома. Ядерная модель атома:
Слайд 9 из презентации «Опыт Резерфорда, модель атома» . Размер архива с презентацией 174 КБ.Физика 9 класс
краткое содержание других презентаций«Строение атома элемента» - Кто открыл явление радиоактивности. Строение. Атом – «неделимый». Резерфорд провел ряд опытов по исследованию строения и состава атомов. Томсон предложил в 1903 г одну из первых моделей строения атома. Анри Беккерель открывает явление радиоактивности. Частица вызывала на экране вспышку. Два события в конце 19 века привели к мысли о сложном строении атома. Строение атома. Планетарная (ядерная) модель.
«Камера Вильсона» - Назначение прибора. Принцип роботы. Усовершенствование. Емкость. Изобретатель прибора. Значение. Камера. Вильсон. Камера Вильсона. Устройство.
«Безопасность атомной энергетики» - Из истории атомной энергетики. Реакция распада ядер урана. Схема работы кипящего ядерного реактора. Безопасность. Схема кипящего ядерного реактора. АЭС имеют больше возможностей в производстве энергии. Атомные электростанции. Вред атомной энергетики. Атомные электростанции на карте России. Ядерный реактор. Атомная энергетика. Термоядерный синтез. Польза и вред атомной энергетики. Атомные ледоколы.
«Физика «Движение»» - Взаимодействие тел. Механика. Закон сохранения в механике. Строение атома. Инертность и масса тел. Скорость при неравномерном движении. Как изменяются координаты. Перемещение при прямолинейном равноускоренном движении. Основы динамики. Работа силы. 2 закон Ньютона. Свободное падение тел. Основы физики. Изучении свойств материи. Вектор. 3 закон Ньютона. Период и частота обращения. Ускорение. Физика-это точная наука.
«Колебания математического маятника» - План урока. Практическое использование колебаний маятника. Галилео Галилей (1564-1642). Гюйгенс Христиан (1629 – 1695). Любое ли тело может совершать колебательные движения. Опыт был выполнен в узком кругу. Иллюстрация механических колебаний на примере маятника Фуко. Старое здание Пизанского университета. Реальный маятник можно считать математическим, если длина нити много больше размеров подвешенного на ней тела.
«Первая космическая скорость» - Решите задачи. Ускорение свободного падении. Скорость, которую необходимо сообщить телу, чтобы оно стало спутником. Представление об ИСЗ. Первая космическая скорость. Условия, при которых тело становится ИСЗ. Искусственные спутники Земли. Определить первую космическую скорость для запуска спутника. Решите задачу. Обращение планет вокруг Солнца.
Эрнест Резерфорд - это один из основателей фундаментального учения о внутреннем строении атома. Родился ученый в Англии, в семье эмигрантов из Шотландии. Резерфорд был четвертым ребенком в своей семье, при этом оказался самым талантливым. Особый вклад ему удалось внести в теорию строения атома.
Первоначальные представления о строении атома
Нужно отметить, что до того, как был проведен знаменитый опыт Резерфорда по рассеянию альфа-частиц, господствующей на то время идеей о строении атома была модель Томпсона. Этот ученый был уверен, что положительный заряд равномерно заполнял весь объем атома целиком. Отрицательно заряженные электроны, считал Томпсон, были будто бы вкраплениями в него.

Предпосылки к научному перевороту
После окончании школы Резерфорд как самый талантливый ученик получил грант в 50 фунтов для дальнейшего обучения. Благодаря этому он сумел поступить в колледж в Новой Зеландии. Далее молодой ученый сдает экзамены в Кентерберийском университете и начинает серьезно заниматься физикой и химией. В 1891 году Резерфорд сделал свой первый доклад на тему «Эволюция элементов». В нем впервые в истории была обозначена идея о том, что атомы представляют собой сложнейшие структуры.
Тогда в научных кругах господствовала идея Дальтона о том, что атомы неделимы. Всем, кто окружал Резерфорда, его идее показались совершенным безумием. Молодому ученому приходилось постоянно приносить извинения коллегам за свою «чепуху». Но через 12 лет Резерфорд все же сумел доказать свою правоту. У Резерфорда появился шанс продолжить свои исследования в Кавендишской лаборатории в Англии, где он начал изучать процессы ионизации воздуха. Первым открытием Резерфорда были альфа- и бета-лучи.

Опыт Резерфорда
Кратко об открытиии можно рассказать так: в 1912 году Резерфорд вместе со своими помощниками провел свой знаменитый опыт - альфа-частицы испускались из свинцового источника. Все частицы, кроме тех, что оказывались поглощенными свинцом, двигались вдоль установленного канала. Их узкий поток попадал на тонкий слой фольги. Эта линия была перпендикулярна листу. Опыт Резерфорда по рассеянию альфа-частиц доказал: те частицы, которые проходили сквозь лист фольги насквозь, вызывали так называемые сцинтилляции на экране.
Этот экран был покрыт особым веществом, которое начинало светиться при попадании на него альфа-частиц. Пространство между слоем и экраном было заполнено вакуумом для того, чтобы альфа-частицы не рассеивались в воздухе. Такой прибор позволил исследователям наблюдать частицы, рассеивающиеся под углом порядка 150°.
Если же фольгу не использовали в качестве препятствия перед пучком из альфа-частиц, то на экране образовывался светлый кружок из сцинтилляций. Но как только перед их лучом ставили барьер из золотой фольги, то картина сильно менялась. Вспышки появлялись не только вне этого кружка, но и на противоположной стороне фольги. Опыт Резерфорда по рассеянию альфа-частиц показал, что большинство частиц проходит через фольгу без заметных изменений в траектории движения.
При этом некоторые частицы отклонялись под довольно большим углом и даже отбрасывались назад. На каждые 10 000 свободно проходящих через слой золотой фольги частиц лишь одна отклонялась на угол, превышавший 10° - в виде исключения одна из частиц отклонялась на такой угол.

Причина, по которой отклонялись альфа-частицы
То, что детально рассмотрел и доказал опыт Резерфорда - строение атома. Такое положение свидетельствовало о том, что атом не представляет собой сплошное образование. Большинство частиц свободно проходили через фольгу толщиной в один атом. И поскольку масса альфа-частицы практически в 8 000 раз больше массы электрона, то последний не мог бы существенно повлиять на траекторию альфа-частицы. Это могло бы быть сделанным лишь атомным ядром - телом малых размеров, обладающим почти всей массой и всем электрическим зарядом атома. На тот момент это стало значительным прорывом английского физика. Опыт Резерфорда считается одной из важнейших ступеней в становлении науки о внутреннем строении атома.
Другие открытия, полученные в процессе изучения атома
Эти исследования стали прямым доказательством того, что положительный заряд атома находится внутри его ядра. Эта область занимает весьма малое пространство по сравнению с его целостными размерами. В таком малом объеме рассеяние альфа-частиц оказалось очень маловероятным. А те частицы, которые проходили вблизи области атомного ядра, испытывали резкие отклонения от траектории, ведь отталкивающие силы между альфа-частицей и ядром атома были очень мощными. Опыт Резерфорда по рассеянию альфа-частиц доказал вероятность того, что альфа-частица попадет прямо в ядро. Правда, вероятность была очень мала, но все же не равна нулю.
Это был не единственный факт, который доказал опыт Резерфорда. Кратко строение атома изучали и его коллеги, которые сделали ряд других важных открытий. Кроме учения о том, что альфа-частицы представляют собой быстро движущиеся ядра гелия.
Ученый смог описать строение атома, в котором ядро занимает незначительную часть всего объема. Его опыты доказали, что практически весь заряд атома сосредоточен внутри его ядра. При этом происходят как случаи отклонения альфа-частиц, так и случаи их столкновения с ядром.

Опыты Резерфорда: ядерная модель атома
В 1911 году Резерфорд после многочисленных исследований предложил которую назвал планетарной. Согласно данной модели, внутри атома расположено ядро, которое содержит в себе практически всю массу частицы. Электроны движутся вокруг ядра подобно тому, как это делают планеты вокруг Солнца. Из их совокупности образуется так называемое электронное облако. Атом же имеет нейтральный заряд, как показал опыт Резерфорда.
Строение атома в дальнейшем заинтересовало ученого по имени Нильс Бор. Именно он доработал учение Резерфорда, ведь до Бора планетарная модель атома стала сталкиваться с трудностями объяснения. Так как электрон движется вокруг ядра по определенной орбите с ускорением, рано или поздно он должен упасть на ядро атома. Однако Нильс Бор смог доказать, что внутри атома законы классической механики уже не действуют.
Слово «атом» в переводе с греческого означает «неделимый». Под атомом долгое время, вплоть до начала XX в., подразумевали мельчайшие неделимые частицы вещества. К началу XX в. в науке накопилось много фактов, говоривших о сложном строении атомов.
Большие успехи в исследовании строения атомов были достигнуты в опытах английского ученого Эрнеста Резерфорда по рассеянию а- частиц при прохождении через тонкие слои вещества. В этих опытах узкий пучок α -частиц, испускаемых радиоактивным веществом, направлялся на тонкую золотую фольгу. За фольгой помещался экран, способный светиться под ударами быстрых частиц. Было обнаружено, что большинство α -частиц отклоняется от прямолинейного распространения после прохождения фольги, т. е. рассеивается, а некоторые α -частицы вообще отбрасываются назад. Рассеяние α -частиц Резерфорд объяснил тем, что положительный заряд не распределен равномерно в шаре радиусом 10 -10 м, как предполагали ранее, а сосредоточен в центральной части атома - атомном ядре. При прохождении около ядра α -частица, имеющая положительный заряд, отталкивается от него, а при попадании в ядро - отбрасывается в противоположном направлении. Так ведут себя частицы, имеющие одинаковый заряд, следовательно, существует центральная положительно заряженная часть атома, в которой сосредоточена значительная масса атома. Расчеты показали, что для объяснения опытов нужно принять радиус атомного ядра равным примерно 10 -15 μ.
Резерфорд предположил, что атом устроен подобно планетарной системе. Суть модели строения атома по Резерфорду заключается в следующем: в центре атома находится положительно заряженное ядро, в котором сосредоточена вся масса, вокруг ядра по круговым орбитам на больших расстояниях вращаются электроны (как планеты вокруг Солнца). Заряд ядра совпадает с номером химического элемента в таблице Менделеева.
Планетарная модель строения атома по Резерфорду не смогла объяснить ряд известных фактов:
электрон, имеющий заряд, должен за счет кулоновских сил притяжения упасть на ядро, а атом - это устойчивая система; при движении по круговой орбите, приближаясь к ядру, электрон в атоме должен излучать электромагнитные волны всевозможных частот, т. е. излучаемый свет должен иметь непрерывный спектр, на практике же получается иное:
электроны атомов излучают свет, имеющий линейчатый спектр. Разрешить противоречия планетарной ядерной модели строения атома первым попытался датский физик Нильс Бор.
Билет №23
Квантовые постулаты Бора. Испускание и поглощение света атомами. Спектральный анализ
План ответа
1. Первый постулат. 2. Второй постулат. 3. Виды спектров.
В основу своей теории Бор положил два постулата. Первый постулат: атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует своя энергия; в стационарном состоянии атом не излучает.
Это означает, что электрон (например, в атоме водорода) может находиться на нескольких вполне определенных орбитах. Каждой орбите электрона соответствует вполне определенная энергия.
Второй постулат: при переходе из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения. Энергия фотона равна разности энергий атома в двух состояниях: hv = Е m – Ε n ; h = 6,62 10 -34 Дж с, где h - постоянная Планка.
При переходе электрона с ближней орбиты на более удаленную, атомная система поглощает квант энергии. При переходе с более удаленной орбиты электрона на ближнюю орбиту по отношению к ядру атомная система излучает квант энергии.
Теория Бора позволила объяснить существование линейчатых спектров.
Спектр излучения (или поглощения) - это набор волн определенных частот, которые излучает (или поглощает) атом данного вещества.
Спектры бывают сплошные, линейчатые и полосатые.
Сплошные спектры излучают все вещества, находящиеся в твердом или жидком состоянии. Сплошной спектр содержит волны всех частот видимого света и поэтому выглядит как цветная полоса с плавным переходом от одного цвета к другому в таком порядке: Красный, Оранжевый, Желтый, Зеленый, Синий и Фиолетовый (Каждый Охотник Желает Знать, где Сидит Фазан).
Линейчатые спектры излучают все вещества в атомарном состоянии. Атомы всех веществ излучают свойственные только им наборы волн вполне определенных частот. Как у каждого человека свои личные отпечатки пальцев, так и у атома данного вещества свой, характерный только ему спектр. Линейчатые спектры излучения выглядят как цветные линии, разделенные промежутками. Природа линейчатых спектров объясняется тем, что у атомов конкретного вещества существуют только ему свойственные стационарные состояния со своей характерной энергией, а следовательно, и свой набор пар энергетических уровней, которые может менять атом, т. е. электрон в атоме может переходить только с одних определенных орбит на другие, вполне определенные орбиты для данного химического вещества.
Полосатые спектры излучаются молекулами. Выглядят полосатые спектры подобно линейчатым, только вместо отдельных линий наблюдаются отдельные серии линий, воспринимаемые как отдельные полосы.
Характерным является то, что какой спектр излучается данными атомами, такой же и поглощается, т. е. спектры излучения по набору излучаемых частот совпадают со спектрами поглощения. Поскольку атомам разных веществ соответствуют свойственные только им спектры, то существует способ определения химического состава вещества методом изучения его спектров. Этот способ называется спектральным анализом. Спектральный анализ применяется для определения химического состава ископаемых руд при добыче полезных ископаемых, для определения химического состава звезд, атмосфер, планет; является основным методом контроля состава вещества в металлургии и машиностроении.
Билет №24
Фотоэффект и его законы. Уравнение Эйнштейна для фотоэффекта и постоянная Планка. Применение фотоэффекта в технике
Плав ответа
1. Гипотеза Планка. 2. Определение фотоэффекта. 3. Законы фотоэффекта. 4. Уравнение Эйнштейна. 5. Применение фотоэффекта.
В 1900 г. немецкий физик Макс Планк высказал гипотезу: свет излучается и поглощается отдельными порциями - квантами (или фотонами). Энергия каждого фотона определяется формулой Е = hν , где h - постоянная Планка, равная 6,63 10 -34 Дж с, ν - частота света. Гипотеза Планка объяснила многие явления: в частности, явление фотоэффекта, открытого в 1887 г. немецким ученым Генрихом Герцем и изученного экспериментально русским ученым А. Г. Столетовым.
Фотоэффект - это явление испускания электронов веществом под действием света.
В результате исследований были установлены три закона фотоэффекта.
1. Сила тока насыщения прямо пропорциональна интенсивности светового излучения, падающего на поверхность тела.
2. Максимальная кинетическая энергия фотоэлектронов линейно возрастает с частотой света и зависит от его интенсивности.
3. Если частота света меньше некоторой определенной для данного вещества минимальной частоты, то фотоэффект не происходит.
Зависимость фототока от напряжения показана на рисунке 36.
Теорию фотоэффекта создал немецкий ученый А. Эйнштейн в 1905 г. В основе теории Эйнштейна лежит понятие работы выхода электронов из металла и понятие о квантовом излучении света. По теории Эйнштейна фотоэффект имеет следующее объяснение: поглощая квант света, электрон приобретает энергию hv . При вылете из металла энергия каждого электрона уменьшается на определенную величину, которую называют работой выхода (А вых). Работа выхода - это работа, которую необходимо затратить, чтобы удалить электрон из металла. Максимальная энергия электронов после вылета (если нет других потерь) имеет вид: mv 2 /2 = hv - А вых, Это уравнение носит название уравнения Эйнштейна.
Если hν < А вых то фотоэффект не происходит. Значит, красная граница фотоэффекта равна ν min = А вых /h
Приборы, в основе принципа действия которых лежит явление фотоэффекта, называют фотоэлементами. Простейшим таким прибором является вакуумный фотоэлемент. Недостатками такого фотоэлемента являются: слабый ток, малая чувствительность к длинноволновому излучению, сложность в изготовлении, невозможность использования в цепях переменного тока. Применяется в фотометрии для измерения силы света, яркости, освещенности, в кино для воспроизведения звука, в фототелеграфах и фототелефонах, в управлении производственными процессами.
Существуют полупроводниковые фотоэлементы, в которых под действием света происходит изменение концентрации носителей тока.Они используются при автоматическом управлении электрическими цепями (например, в турникетах метро), в цепях переменного тока, в качестве невозобновляемых источников тока в часах, микрокалькуляторах, проходят испытания первые солнечные автомобили, используются в солнечных батареях на искусственных спутниках Земли, межпланетных и орбитальных автоматических станциях.
С явлением фотоэффекта связаны фотохимические процессы, протекающие под действием света в фотографических материалах.
 Могильники Чернобыля: радиоактивные отходы зоны отчуждения Где находится техника чернобыля
Могильники Чернобыля: радиоактивные отходы зоны отчуждения Где находится техника чернобыля Девочка заговорила на иностранном языке после комы
Девочка заговорила на иностранном языке после комы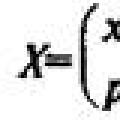 Сравнение законов распределения вероятностей
Сравнение законов распределения вероятностей