Каков физический смысл волновой функции. Применение уравнения Шредингера к атому водорода. Квантовые числа. Условия регулярности волновой функции
> Волновая функция
Читайте о волновой функции и теории вероятностей квантовой механики: суть уравнения Шредингера, состояние квантовой частицы, гармонический осциллятор, схема.
Речь идет об амплитуде вероятности в квантовой механике, описывающей квантовое состояние частицы и ее поведение.
Задача обучения
- Объединить волновую функцию и плотность вероятности определения частички.
Основные пункты
- |ψ| 2 (x) соответствует плотности вероятности определения частички в конкретном месте и моменте.
- Законы квантовой механики характеризуют эволюцию волновой функции. Уравнение Шредингера объясняет ее наименование.
- Волновая функция должна удовлетворять множество математических ограничений для вычислений и физической интерпретации.
Термины
- Уравнение Шредингера – частичный дифференциал, характеризующий изменение состояния физической системы. Его сформулировал в 1925 году Эрвин Шредингер.
- Гармонический осциллятор – система, которая при смещении от изначальной позиции, испытывает влияние силы F, пропорциональной смещению х.
В пределах квантовой механики волновая функция отображает амплитуду вероятности, характеризующую квантовое состояние частички и ее поведение. Обычно значение – комплексное число. Наиболее распространенными символами волновой функции выступают ψ (x) или Ψ(x). Хотя ψ – комплексное число, |ψ| 2 – вещественное и соответствует плотности вероятности нахождения частицы в конкретном месте и времени.
Здесь отображены траектории гармонического осциллятора в классической (А-В) и квантовой (C- H) механиках. В квантовой шар обладает волновой функцией, отображенной с реальной частью в синем и мнимой в красном. Траектории C- F – примеры стоячих волн. Каждая такая частота будет пропорциональной возможному уровню энергии осциллятора
Законы квантовой механики эволюционируют со временем. Волновая функция напоминает другие, вроде волн в воде или струне. Дело в том, что формула Шредингера выступает типом волнового уравнения в математике. Это приводит к двойственности волновых частиц.
Волновая функция обязана соответствовать ограничениям:
- всегда конечная.
- всегда непрерывная и непрерывно дифференцируемая.
- удовлетворяет соответствующее условие нормировки, чтобы частичка существовала со 100% определенностью.
Если требования не удовлетворены, то волновую функцию нельзя интерпретировать в качестве амплитуды вероятности. Если мы проигнорируем эти позиции и воспользуемся волновой функцией, чтобы определить наблюдения квантовой системы, то не получим конечных и определенных значений.
Обнаружение волновых свойств микрочастиц свидетельствовало о том, что классическая механика не может дать правильного описания поведения таких частиц. Теория, охватывающая все свойства элементарных частиц, должна учитывать не только их корпускулярные свойства, но и волновые. Из опытов, рассмотренных ранее, следует, что пучок элементарных частиц обладает свойствами плоской волны, распространяющейся в направлении скорости частиц. В случае распространения вдоль оси этот волновой процесс может быть описан уравнением волны де Бройля (7.43.5):
 (7.44.1)
(7.44.1)
где – энергия, – импульс частицы. При распространении в произвольном направлении :
 (7.44.2)
(7.44.2)
Назовем функцию волновой функцией и выясним ее физический смысл путём сравнения дифракции световых волн и микрочастиц.
Согласно волновым представлениям о природе света, интенсивность дифракционной картины пропорциональна квадрату амплитуды световой волны. По представлениям фотонной теории, интенсивность определяется числом фотонов, попадающих в данную точку дифракционной картины. Следовательно, число фотонов в данной точке дифракционной картины задаётся квадратом амплитуды световой волны, в то время как для одного фотона квадрат амплитуды определяет вероятность попадания фотона в ту или иную точку.
Дифракционная картина, наблюдаемая для микрочастиц, также характеризуется неодинаковым распределением потоков микрочастиц. Наличие максимумов в дифракционной картине с точки зрения волновой теории означает, что эти направления соответствуют наибольшей интенсивности волн де Бройля. Интенсивность же больше там, где больше число частиц. Таким образом, дифракционная картина для микрочастиц является проявлением статистической закономерности и можно говорить, что знание вида волны де Бройля, т.е. Ψ -функции, позволяет судить о вероятности того или иного из возможных процессов.
Итак, в квантовой механике состояние микрочастиц описывается принципиально по-новому – с помощью волновой функции, которая является основным носителем информации об их корпускулярных и волновых свойствах. Вероятность нахождения частицы в элементе объёмом равна
![]() (7.44.3)
(7.44.3)
Величина
 (7.44.4)
(7.44.4)
имеет смысл плотности вероятности, т.е. определяет вероятность нахождения частицы в единичном объёме в окрестности заданной точки. Таким образом, физический смысл имеет не сама - функция, а квадрат её модуля , которым задаётся интенсивность волн де Бройля. Вероятность найти частицу в момент времени в конечном объёме , согласно теореме сложения вероятностей, равна
 (7.44.5)
(7.44.5)
Так как частица существует, то она обязательно где-то обнаруживается в пространстве. Вероятность достоверного события равна единице, тогда
 . (7.44.6)
. (7.44.6)
Выражение (7.44.6) называется условием нормировки вероятности. Волновая функция , характеризующая вероятность обнаружения действия микрочастицы в элементе объёма, должна быть конечной (вероятность не может быть больше единицы), однозначной (вероятность не может быть неоднозначной величиной) и непрерывной (вероятность не может изменяться скачком).
Постулаты Бора
Планетарная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц вещества, однако возникли принципиальные трудности при обосновании устойчивости атомов.
Первая попытка построить качественно новую – квантовую – теорию атома была предпринята в 1913 г. Нильсом Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил ядерную модель Резерфорда. Он предположил, что электроны движутся вокруг ядра по круговым орбитам. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы – очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности. В основу своей теории атома Бор положил следующие постулаты.
Первый постулат Бора
(постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
Этот постулат находится в противоречии с классической теорией. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантовые значения момента импульса.
Второй постулат Бора
(правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
равной разности энергий соответствующих стационарных состояний (Еn и Еm – соответственно энергии стационарных состояний атома до и после излучения/поглощения).
Переходу электрона со стационарной орбиты под номером m на стационарную орбиту под номером n
соответствует переход атома из состояния с энергией Еm
в состояние с энергией Еn (рис. 4.1).
Рис. 4.1. К пояснению постулатов Бора
При Еn > Еm происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn < Еm – его поглощение (переход атома в состояние с большей энергией, т. е, переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот![]()
квантовых переходов и определяет линейчатый спектр атома.
Теория Бора блестяще объяснила экспериментально наблюдаемый линейчатый спектр водорода.
Успехи теории атома водорода были получены ценой отказа от фундаментальных положений классической механики, которая на протяжении более 200 лет остается безусловно справедливой. Поэтому большое значение имело прямое экспериментальное доказательство справедливости постулатов Бора, особенно первого – о существовании стационарных состояний. Второй постулат можно рассматривать как следствие закона сохранения энергии и гипотезы о существовании фотонов.
Немецкие физики Д. Франк и Г. Герц, изучая методом задерживающего потенциала столкновение электронов с атомами газов (1913г.), экспериментально подтвердили существование стационарных состояний и дискретность значений энергии атомов.
Несмотря на несомненный успех концепции Бора применительно к атому водорода, для которого оказалось возможным построить количественную теорию спектра, создать подобную теорию для следующего за водородом атома гелия на основе представлений Бора не удалось. Относительно атома гелия и более сложных атомов теория Бора позволила делать лишь качественные (хотя и очень важные) заключения. Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось весьма условным. На самом деле движение электронов в атоме имеет мало общего с движением планет по орбитам.
В настоящее время с помощью квантовой механики можно ответить на многие вопросы, касающиеся строения и свойств атомов любых элементов.
5. основные положения квантовой механики:
Волновая функция и ее физический смысл.
Из содержания предыдущих двух параграфов следует, что с микрочастицей сопоставляют волновой процесс, который соответствует ее движению, поэтому состояние частицы в квантовой механике описывают волновой функцией , которая зависит от координат и времени y(x,y,z,t). Конкретный вид y -функции определяется состоянием частицы, характером действующих на нее сил. Если силовое поле, действующее на частицу, является стационарным, т.е. не зависящим от времени, то y -функцию можно представить в виде произведения двух сомножителей, один из которых зависит от времени, а другой – от координат:
В дальнейшем будем рассматривать только стационарные состояния. y-функция является вероятностной характеристикой состояния частицы. Чтобы пояснить это, мысленно выделим достаточно малый объем , в пределах которого значения y-функции будем считать одинаковыми. Тогда вероятность нахождения dW частицы в данном объеме пропорциональна ему и зависит от квадрата модуля y-функции (квадрата модуля амплитуды волн де Бройля):
Отсюда следует физический смысл волновой функции:
Квадрат модуля волновой функции имеет смысл плотности вероятности, т.е. определяет вероятность нахождения частицы в единичном объеме в окрестности точки с координатами х, у, z.
Интегрируя выражение (3.2) по объему, определяем вероятность нахождения частицы в этом объеме в условиях стационарного поля:
Если известно, что частица находится в пределах объема V, то интеграл выражения (3.4), взятый по объему V, должен быть равен единице:
– условие нормировки y-функции.
Чтобы волновая функция являлась объективной характеристикой состояния микрочастиц, она должна быть конечной, однозначной, непрерывной , так как вероятность не может быть больше единицы, не может быть неоднозначной величиной и не может изменяться скачками. Таким образом, состояние микрочастицы полностью определяется волновой функцией. Частица может быть обнаружена в любой точке пространства, в которой волновая функция отлична от нуля.
корпускулярно -- волновым дуализмом в квантовой физике состояние частицы описывается при помощи волновой функции ($\psi (\overrightarrow{r},t)$- пси-функция).
Определение 1
Волновая функция -- это функция, которая используется в квантовой механике. Она описывает состояние системы, которая имеет размеры в пространстве. Она является вектором состояния.
Данная функция является комплексной и формально имеет волновые свойства. Движение любой частицы микромира определено вероятностными законами. Распределение вероятности выявляется при проведении большого числа наблюдений (измерений) или большого количества частиц. Полученное распределение аналогично распределению интенсивности волны. То есть в местах с максимальной интенсивностью отмечено максимальное количество частиц.
Набор аргументов волновой функции определяет ее представление. Так, возможно координатное представление: $\psi(\overrightarrow{r},t)$, импульсное представление: $\psi"(\overrightarrow{p},t)$ и т.д.
В квантовой физике целью ставится не точность предсказания события, а оценка вероятности того или иного события. Зная величину вероятности, находят средние значения физических величин. Волновая функция позволяет находить подобные вероятности.
Так вероятность присутствия микрочастицы в объеме dV в момент времени t может быть определена как:
где $\psi^*$- комплексно сопряженная функция к функции $\psi.$ Плотность вероятности (вероятность в единице объёма) равна:
Вероятность является величиной, которую можно наблюдать в эксперименте. В это же время волновая функция не доступна для наблюдения, так как она является комплексной (в классической физике параметры, которые характеризуют состояние частицы, доступны для наблюдения).
Условие нормировки $\psi$- функции
Волновая функция определена с точностью до произвольного постоянного множителя. Данный факт не оказывает влияния на состояние частицы, которую $\psi$- функция описывает. Однако волновую функцию выбирают таким образом, что она удовлетворяет условию нормировки:
где интеграл берут по всему пространству или по области, в которой волновая функция не равна нулю. Условие нормировки (2) значит то, что во всей области, где $\psi\ne 0$ частица достоверно присутствует. Волновую функцию, которая подчинятся условию нормировки, называют нормированной. Если ${\left|\psi\right|}^2=0$, то данное условие означает, что частицы в исследуемой области наверняка нет.
Нормировка вида (2) возможна при дискретном спектре собственных значений.
Условие нормировки может оказаться не осуществимым. Так, если $\psi$ -- функция является плоской волной де-Бройля и вероятность нахождения частицы является одинаковой для всех точек пространства. Данные случаи рассматривают как идеальную модель, в которой частица присутствует в большой, но имеющей ограничения области пространства.
Принцип суперпозиции волновой функции
Данный принцип является одним их основных постулатов квантовой теории. Его смысл в следующем: если для некоторой системы возможны состояния, описываемые волновыми функциями $\psi_1\ {\rm и}\ $ $\psi_2$, то для этой системы существует состояние:
где $C_{1\ }и\ C_2$ -- постоянные коэффициенты. Принцип суперпозиции подтверждается эмпирически.
Можно говорить о сложении любого количества квантовых состояний:
где ${\left|C_n\right|}^2$ -- вероятность того, что система обнаруживается в состоянии, которое описывается волновой функцией $\psi_n.$ Для волновых функций, подчиненных условию нормировки (2) выполняется условие:
Стационарные состояния
В квантовой теории особую роль имеют стационарные состояния (состояния в которых все наблюдаемые физические параметры не изменяются во времени). (Сама волновая функция принципиально не наблюдаема). В стационарном состоянии $\psi$- функция имеет вид:
где $\omega =\frac{E}{\hbar }$, $\psi\left(\overrightarrow{r}\right)$ не зависит от времени, $E$- энергия частицы. При виде (3) волновой функции плотность вероятности ($P$) является постоянной времени:
Из физических свойств стационарных состояний следуют математические требования к волновой функции $\psi\left(\overrightarrow{r}\right)\to \ (\psi(x,y,z))$.
Математические требования к волновой функции для стационарных состояний
$\psi\left(\overrightarrow{r}\right)$- функция должна быть во всех точках:
- непрерывна,
- однозначна,
- конечна.
Если потенциальная энергия имеет поверхность разрыва, то на подобных поверхностях функция $\psi\left(\overrightarrow{r}\right)$ и ее первая производная должны оставаться непрерывными. В области пространства, где потенциальная энергия становится бесконечной, $\psi\left(\overrightarrow{r}\right)$ должна быть равна нулю. Непрерывность функции $\psi\left(\overrightarrow{r}\right)$ требует, чтобы на любой границе этой области $\psi\left(\overrightarrow{r}\right)=0$. Условие непрерывности накладывается на частные производные от волновой функции ($\frac{\partial \psi}{\partial x},\ \frac{\partial \psi}{\partial y},\frac{\partial \psi}{\partial z}$).
Пример 1
Задание: Для некоторой частицы задана волновая функция вида: $\psi=\frac{A}{r}e^{-{r}/{a}}$, где $r$ -- расстояние от частицы до центра силы (рис.1), $a=const$. Примените условие нормировки, найдите нормировочный коэффициент A.
Рисунок 1.
Решение:
Запишем условие нормировки для нашего случая в виде:
\[\int{{\left|\psi\right|}^2dV=\int{\psi\psi^*dV=1\left(1.1\right),}}\]
где $dV=4\pi r^2dr$ (см.рис.1 Из условий понятно, что задача обладает сферической симметрией). Из условий задачи имеем:
\[\psi=\frac{A}{r}e^{-{r}/{a}}\to \psi^*=\frac{A}{r}e^{-{r}/{a}}\left(1.2\right).\]
Подставим $dV$ и волновые функции (1.2) в условие нормировки:
\[\int\limits^{\infty }_0{\frac{A^2}{r^2}e^{-{2r}/{a}}4\pi r^2dr=1\left(1.3\right).}\]
Проведем интегрирование в левой части:
\[\int\limits^{\infty }_0{\frac{A^2}{r^2}e^{-{2r}/{a}}4\pi r^2dr=2\pi A^2a=1\left(1.4\right).}\]
Из формулы (1.4) выразим искомый коэффициент:
Ответ: $A=\sqrt{\frac{1}{2\pi a}}.$
Пример 2
Задание: Каково наиболее вероятное расстояние ($r_B$) электрона от ядра, если волновая функция, которая описывает основное состояние электрона в атоме водорода может быть определена как: $\psi=Ae^{-{r}/{a}}$, где $r$- расстояние от электрона до ядра, $a$ -- первый Боровский радиус?
Решение:
Используем формулу, которая определяет вероятность присутствия микрочастицы в объеме $dV$ в момент времени $t$:
где $dV=4\pi r^2dr.\ $Следователно, имеем:
В таком случае, $p=\frac{dP}{dr}$ запишем как:
Для определения наиболее вероятного расстояния производную $\frac{dp}{dr}$ приравняетм к нулю:
\[{\left.\frac{dp}{dr}\right|}_{r=r_B}=8\pi rA^2e^{-{2r}/{a}}+4\pi r^2A^2e^{-{2r}/{a}}\left(-\frac{2}{a}\right)=8\pi rA^2e^{-{2r}/{a}}\left(1-\frac{r}{a}\right)=0(2.4)\]
Так как решение $8\pi rA^2e^{-{2r_B}/{a}}=0\ \ {\rm при}\ \ r_B\to \infty $, нам не подходит, то отсается:
 Могильники Чернобыля: радиоактивные отходы зоны отчуждения Где находится техника чернобыля
Могильники Чернобыля: радиоактивные отходы зоны отчуждения Где находится техника чернобыля Девочка заговорила на иностранном языке после комы
Девочка заговорила на иностранном языке после комы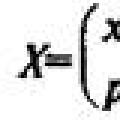 Сравнение законов распределения вероятностей
Сравнение законов распределения вероятностей