Что физическая химическая теории растворов. Физико-химическая теория растворов электролитов и неэлектролитов. Ненасыщенные, насыщенные и пересыщенные растворы


конце XIX века растворы считались физическими образованиями, в которых отсутствуют какие-либо взаимодействия между растворителем и растворенным веществом. Образование раствора объяснялось диспергированием частиц растворенного вещества в индифферентной среде растворителя. Основоположниками этих взглядов были такие известные ученые, как Я. Вант-Гофф, С. Арре-ниус и В. Оствальд. В 1887 году великий русский химик Д. И. Менделеев, опираясь на многочисленные экспериментальные данные, создал химическую (гидратную) теорию растворов. Основой этой теории была идея о химическом характере растворения. В растворе образуются соединения между растворенным веществом и растворителем, изменяющие свой состав с изменением температуры и концентрации. Эти соединения были названы Д. И. Менделеевым гидратами, или - сольватами. Образующиеся гидраты имеют различную прочность. Большинство из них неустойчиво и существует только в растворах. Однако некоторая часть гидратов является настолько прочными соединениями, что при выделении растворенного вещества из раствора вода входит в состав растущего кристалла в химически связанном виде. Такие кристаллы были названы кристаллогидратами, а входящая в их состав вода - кристаллизационной. Примерами кристаллогидратов являются CuS04 5Н20; Na2S04 ЮН20 и др. Прочность образующихся соединений определяется силами, действующими между растворителем и растворенным веществом. В настоящее время известна природа этих сил. СольватЫ (гидраты) образуются за счет ион-дипольного, диполь-ди-польного, донорно-акцепторного взаимодействия, за счет водородных связей, а также дисперсионного взаимодействия. Менделеев не отрицал роль физического фактора при образовании растворов. Он писал: «Две указанные стороны растворения (физическая и химическая) и гипотезы, до сих пор приложенные к рассмотрению растворов, хотя имеют отчасти различные исходные точки, со временем приведут к общей теории растворов, потому что одни общие законы управляют как физическими, так и химическими явлениями». Взгляды Д. И. Менделеева полностью подтвердились. В настоящее время процесс растворения рассматривают как физико-химический процесс, а растворы - как физико-химические системы. Химическая теория растворов Д. И. Менделеева позволяла объяснить наличие тепловых эффектов, возникающих при процессах растворения веществ. Тепловой эффект процесса растворения (ДНраств) можно представить в виде суммы теплоты, необходимой для разрушения кристаллической решетки вещества (ДНре1:1) и теплоты, выделяющейся в процессе сольватации (ДНсольват), т. е. AHp^ является значительной эндотермической величиной, а ДНС0ЛЬВ близкая к ней по значению экзотермическая величина. Исходя из этого, конечный знак теплового эффекта процесса растворения будет определяться величиной вклада каждого из этих параметров. При растворения эндотермичен. Это можно наблюдать, например, при растворении в воде нитратов калия и аммония, хлорида калия и др. При процесс растворения экзотермичен. Примером этого является растворение в воде хлоридов кальция и магния, гидроксидов натрия и калия и др. Итак, знак теплового эффекта определяется природой растворенного вещества и растворителя, глубиной их взаимодействия между собой. Наличием химического взаимодействия между компонентами объясняются и объемные эффекты при растворении. Так, при растворении 1 л этилового спирта в 1 л воды объем образующегося раствора оказывается равным не 2 л, а 1,93 л. В этом случае уменьшение объема обусловлено, в основном, образованием водородных связей между гидроксильными группами воды и спирта.
Выше показано, что реакция чистой воды является нейтральной (рН = 7). Водные растворы кислот и оснований имеют, соответственно, кислую (рН < 7) и щелочную (рН > 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию - причиной этого является гидролиз солей. Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей. Рассмотрим гидролиз солей следующих основных типов: 1. Соли сильного основания и сильной кислоты (например, KBr, NаNО3) при растворении в воде не гидролизуются, и раствор соли имеет нейтральную реакцию….

Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия. Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений,…
Для объяснения особенностей водных растворов электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям: 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы (Na+, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3—, SO2-4, РОЗ-4и т.д.). 2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. 3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например,…
![]()
Существенным является вопрос о механизме электролитической диссоциации. Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При…
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н3РО4 Н+ + Н2РО—4(первая ступень) Н2РО—4 Н+ + НРO2-4 (вторая ступень) НРО2-4 Н+ PОЗ—4 (третья ступень) Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4. Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например: KOH K+ + OH—;…
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α). Степень диссоциации — это отношение числа распавшихся на ионы молекул N’ к общему числу растворенных молекул N: Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы. Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита,…
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер. При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Знак ↓, стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак обозначает, что вещество удаляется из сферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные, записывают в виде ионов. Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части. Для закрепления этих положений рассмотрим два примера. Пример 1. Напишите уравнения реакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах. Разобьем решение задачи на четыре этапа. 1….
КH2O = 1.10-4 Данная константа для воды называется ионным произведением воды, которое зависит только от температуры. При диссоциации воды на каждый ион Н+ образуется один ион ОН—, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН—]. Используя значение ионного произведения воды, находим: = [ОН—] = моль/л. Таковы концентрации ионов Н+ и ОН—…
Растворы
Обязательно одним из компонентов является растворитель, остальные компоненты – растворенные вещества.
Растворителем является то вещество, которое в чистом виде имеет то же состояние, что и раствор. Если же таких компонентов несколько, то растворителем является тот, содержание которого в растворе больше.
Растворы бывают:
1. Жидкие (раствор NaCl в воде, раствор I 2 в спирте).
2. Газообразные (смеси газов, например: воздух – 21 % O 2 + 78 % N 2 + 1 % др. газов).
3. Твердые (сплавы металлов, например: Cu + N, Au + Ag).
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых).
| Жидкие растворы | ||
Такие растворы могут быть водные и неводные .
Водные
Неводные
Долгое время на природу растворения существовало две точки зрения: физической и химической. Согласно первой, растворы рассматривались как механические смеси, согласно второй – как нестойкие химические соединения молекул растворенного вещества и растворителя. Последняя точка зрения была высказана Д.И. Менделеевым в 1887 г. и является в настоящее время общепризнанной.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ХИМИЧЕСКОЙ ТЕОРИИ РАСТВОРОВ , созданной Менделеевым, сводятся к следующему:
1. Образование и существование раствора обусловлено взаимодействиями между всеми частицами, как уже существовавшими, так и образующимися при растворении.
2. Раствор является динамической системой, в которой распадающиеся соединения находятся в подвижном равновесии с продуктами распада в соответствии с законом действия масс.
При растворении вещества происходят два процесса, связанные с изменениями энергии системы «вещество – растворитель»:
1) разрушение структуры растворяемого вещества (при этом затрачивается определенная энергия) – реакция эндотермическая.
2) взаимодействие растворителя с частицами растворенного вещества (происходит выделение тепла) – реакция экзотермическая.
В зависимости от соотношения этих тепловых эффектов процесс растворения вещества может быть экзотермическим (∆H < O) или эндотермическим (∆H > O).
Теплота растворения ∆H – это количество теплоты, выделяющееся или поглощающееся при растворении 1 моль вещества.
Теплота растворения для различных веществ различна. Так, при растворении в воде гидроксида калия или серной кислоты температура значительно повышается (∆H < O), а при растворении нитратов калия или аммония резко снижается (∆H > O).
Выделение или поглощение теплоты при растворении есть признак химической реакции. В результате взаимодействия растворенного вещества с растворителем образуются соединения, которые называются сольватами (или гидратами , если растворителем является вода). Многие соединения такого вида непрочны, однако, в ряде случаев образуются прочные соединения, которые легко можно выделить из раствора кристаллизацией.
При этом выпадают кристаллические вещества, содержащие в своем составе молекулы воды, их называют кристаллогидратами (например: медный купорос CuSO 4 * 5 H 2 O – кристаллогидрат); вода, входящая в состав кристаллогидратов, называется кристаллизационной.
Представления о гидратации (соединение вещества с водой) было выдвинуто и развито русским ученым И.А. Каблуковым и В.А. Кистяковским. на основе этих представлений произошло объединение химической и физической точек зрения на растворы.
Таким образом, растворение растворы – физико-химические системы.
1.Растворы – гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов и продукты их взаимодействия.
2.Растворы состоят из растворителя и растворенного вещества.
3.Растворы бывают:
А)Жидкие (раствор NaCl в воде, раствор I 2 в спирте).
Б)Газообразные (смеси газов, например: воздух – 21 % O 2 + 78 % N 2 + 1 % др. газов).
В)Твердые (сплавы металлов, например: Cu + N, Au + Ag).
| Жидкие растворы | ||
| жидкость + газообразное вещество (р-р O 2 в воде) | жидкость + жидкое вещество (р-р H 2 SO 4 в воде) | жидкость + твердое вещество (р-р сахара в воде) |
Такие растворы могут быть водные и неводные .
5.Водные – растворы, в которых растворителем является вода.
6.Неводные – растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и др.)
7.ОСНОВНЫЕ ПОЛОЖЕНИЯ ХИМИЧЕСКОЙ ТЕОРИИ РАСТВОРОВ:
1.Образование и существование раствора обусловлено взаимодействиями между всеми частицами, как уже существовавшими, так и образующимися при растворении.
2.Раствор является динамической системой, в которой распадающиеся соединения находятся в подвижном равновесии с продуктами распада в соответствии с законом действия масс.
8.При растворении вещества происходят два процесса, связанные с изменениями энергии системы «вещество – растворитель»:
1.разрушение структуры растворяемого вещества (при этом затрачивается определенная энергия) – реакция эндотермическая.
2.взаимодействие растворителя с частицами растворенного вещества (происходит выделение тепла) – реакция экзотермическая.
9.Выделение или поглощение теплоты при растворении есть признак химической реакции.
10. В результате взаимодействия растворенного вещества с растворителем образуются соединения, которые называются сольватами (или гидратами , если растворителем является вода)
11.Кристаллические вещества, содержащие в своем составе молекулы воды, называют кристаллогидратами (например: медный купорос CuSO 4 * 5 H 2 O – кристаллогидрат); вода, входящая в состав кристаллогидратов, называется кристаллизационной
12.Растворение – это не только физический, но и химический процесс, а растворы – физико-химические системы.
Виды растворов (знать).
Растворение – процесс обратимый:
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные , ненасыщенные и перенасыщенные .
С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяются на разбавленные концентрированные
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор находится в равновесии с растворяемым веществом, называется насыщенным ненасыщенным . В перенасыщенных Растворимостью Мерой растворимости или коэффициентом растворимости вещества при определенной температуре служит число граммов его, растворяющихся в 100 г воды.
По растворимости в воде твердые вещества условно делят на 3 группы:
1. Вещества, хорошо растворимые в воде (10 г вещества в 100, 0 воды. Например, в 1 л воды растворяется 200 г сахара).
2. Вещества, малорастворимые в воде (от 0, 01 до 10 г вещества в 100 г воды. Например: гипс CaSO 4 в 1 л растворяется 2, 0).
3. Вещества, практически нерастворимые в воде (0, 01 г в 100, 0 воды. Например, AgCl – в 1 л воды растворяется 1, 5 * 10 -3 г).
Растворимость вещества зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов).
Растворимость газов при повышении температуры уменбшается, при повышении давления увеличивается.
Зависимость растворимости твердых веществ от температуры показывает кривая растворимости.
Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить:
1. Коэффициент растворимости веществ при различных температурах.
2. Массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t 1 0 C до t 2 0 C.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией . Перекристаллизация используется для очистки веществ.
К сожалению, до настоящего времени не существует теории, позволяющей объединить результаты отдельных исследований и вывести общие законы растворимости. Подобное положение в значительной степени обусловлено тем, что растворимость различных веществ очень различно зависит от температуры.
Единственно, чем можно до некоторой степени руководствоваться – это старинным, найденным на опыте правилом: подобное растворяется в подобном . Смысл его в свете современных взглядов на строение молекул состоит в том, что если у самого растворителя молекулы неполярные или малополярные (например, бензол, эфир), то в нем будут хорошо растворяться от вещества с неполярными или малополярными молекулами, хуже – вещества с большей полярностью и практически не будут растворяться вещества, построенные по ионному типу. Наоборот, растворитель с сильно выраженным полярным характером молекул (например, вода) будет, как правило, хорошо растворять вещества с молекулами полярного и отчасти ионного типов и плохо – вещества с неполярными молекулами.
1.Растворение – процесс обратимый: растворяемое вещество + растворитель ↔ вещество в растворе ± Q.
2.По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные , ненасыщенные и перенасыщенные .
3.По относительным количествам растворенного вещества и растворителя растворы подразделяются на разбавленные (содержат мало растворенного вещества) и концентрированные (содержат много растворенного вещества).
4.Раствор, в котором данное вещество при данной температуре больше не растворяется называется насыщенным , а раствор, в котором еще можно растворить добавочное количество данного вещества – ненасыщенным . В перенасыщенных растворах вещества содержится больше, чем в насыщенном.
5.Растворимостью называется свойство вещества растворяться в воде и в других растворителях.
6.Растворимость вещества зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов).
4. Способы выражения концентрации растворов: массовая доля
(знать).
Количественный состав раствора определяется его концентрацией.
Концентрация – это количество растворенного вещества, отнесенное к единице объема.
Различают два типа обозначений концентрации веществ – аналитические и технические.
В середине XIX века общепринятой считалась физическая теория растворов, одним из авторов которой являлся Вант-Гофф (Голландия). Эта теория рассматривала растворы как механические смеси, без учета взаимодействий между молекулами растворителя и частицами растворенного вещества.
Факты, которые не могла объяснить физическая теория растворов:
1) Тепловые эффекты растворения.
Пример. Растворение – процесс экзотермический; растворение – эндотермический.
2) Изменение (чаще – уменьшение) объема жидкости при растворении. Это явление называется контракция.
Пример. При смешивании 50 мл и 50 мл образуется 98 мл раствора
3) Изменение окраски некоторых веществ при растворении и некоторых растворов при выпаривании.
Примеры. Безводный сульфат меди(II) – белый порошок – при поглощении воды синеет.
Розовый раствор хлорида кобальта(II) при высыхании окраску не изменяет, а при последующем выпаривании – синеет.
1),2),3) - признаки химических реакций.
Д. И. Менделеев считал, что рассмотренные явления, безусловно, указывают на какие-то взаимодействия между растворенным веществом и растворителем. Он последовательно развивал мысль о химическом взаимодействии между частицами растворенного вещества и молекулами растворителя. Учение Менделеева было развито и дополнено русскими учеными И. А. Каблуковым и В. А. Кистяковским. На основе этих представлений произошло объединение физической и химической точки зрения на растворы.
Основные положения современной физико-химической теории растворов сводятся к следующему.
1) Растворитель и растворенное вещество химически взаимодействуют между собой.
2) В результате взаимодействия образуются непрочные соединения, называемые сольватами, а сам процесс называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а процесс – гидратацией.
Сами растворы, а также большинство гидратов (сольватов), которые образуются при растворении, имеют переменный состав. Этим они отличаются от химических соединений.
Физико-химическая теория растворов позволила объяснить многие непонятные до этого факты:
1) Изменение окраски некоторых веществ при растворении и некоторых растворов при выпаривании.
2) Тепловые эффекты при растворении.
Явление гидратации иногда можно наблюдать, не пользуясь специальными приборами. Например, безводный сульфат меди (II) CuSO 4 – белое вещество. При его растворении в воде образуется голубой раствор. Окраска раствора обусловливается гидратированными ионами меди. Гидратированные частички иногда настолько прочны, что при выделении растворенного вещества из раствора в твердую фазу молекулы воды входят в состав кристаллов. Так, при выпаривании водного раствора сульфата меди в твердую фазу выделяется соль CuSO 4 ∙5H 2 O.
Кристаллические вещества, в состав которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода - кристаллизационной
Аналогично объясняется изменение окраски раствора хлорида кобальта(II) при выпаривании. Гидратированные ионы кобальта в растворе - розового цвета, такой же розовый цвет имеет и кристаллогидрат кобальта (II) CoCl 2 ∙6H 2 O. Но при прокаливании на воздухе кристаллогидрат кобальта теряет кристаллизационную воду и превращается в безводный хлорид кобальта(II) синего цвета.
Образованием кристаллогидратов объясняются и тепловые эффекты при растворении. Тепловой эффект растворения складывается из энергии, затраченной на разрушение кристаллической решетки и отделение частиц растворенного вещества друг от друга, а также энергии, которая выделяется при гидратации.
Какой вклад энергии преобладает, такой тепловой эффект в итоге мы и получаем.
Изменение других термодинамических параметров при растворении.
Так как, в целом, при растворении беспорядок в системе увеличивается.
Так как растворение – процесс самопроизвольный.
 Девочка заговорила на иностранном языке после комы
Девочка заговорила на иностранном языке после комы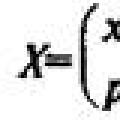 Сравнение законов распределения вероятностей
Сравнение законов распределения вероятностей Советский поэт Асадов Эдуард Аркадьевич: личная жизнь, творчество
Советский поэт Асадов Эдуард Аркадьевич: личная жизнь, творчество